«ethyne» redirects here. Not to be confused with ethane or ethene.

|
|

|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Acetylene[1] |
|
| Systematic IUPAC name
Ethyne[2] |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
|
Beilstein Reference |
906677 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.000.743 |
| EC Number |
|
|
Gmelin Reference |
210 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1001 (dissolved) 3138 (in mixture with ethylene and propylene) |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C2H2 |
| Molar mass | 26.038 g·mol−1 |
| Appearance | Colorless gas |
| Odor | Odorless |
| Density | 1.1772 g/L = 1.1772 kg/m3 (0 °C, 101.3 kPa)[3] |
| Melting point | −80.8 °C (−113.4 °F; 192.3 K) Triple point at 1.27 atm |
|
Sublimation |
−84 °C; −119 °F; 189 K (1 atm) |
|
Solubility in water |
slightly soluble |
| Solubility | slightly soluble in alcohol soluble in acetone, benzene |
| Vapor pressure | 44.2 atm (20 °C)[4] |
| Acidity (pKa) | 25[5] |
| Conjugate acid | Ethynium |
|
Magnetic susceptibility (χ) |
−20.8×10−6 cm3/mol [6] |
| Thermal conductivity | 21.4 mW·m−1·K−1 (300 K) [6] |
| Structure | |
|
Molecular shape |
Linear |
| Thermochemistry[6] | |
|
Heat capacity (C) |
44.036 J·mol−1·K−1 |
|
Std molar |
200.927 J·mol−1·K−1 |
|
Std enthalpy of |
227.400 kJ·mol−1 |
|
Gibbs free energy (ΔfG⦵) |
209.879 kJ·mol−1 |
|
Std enthalpy of |
1300 kJ·mol−1 |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H220, H336 |
|
Precautionary statements |
P202, P210, P233, P261, P271, P304, P312, P340, P377, P381, P403, P405, P501 |
| NFPA 704 (fire diamond) |
1 4 3 |
|
Autoignition |
300 °C (572 °F; 573 K) |
| Explosive limits | 2.5–100% |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
none[4] |
|
REL (Recommended) |
C 2500 ppm (2662 mg/m3)[4] |
|
IDLH (Immediate danger) |
N.D.[4] |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Acetylene (systematic name: ethyne) is the chemical compound with the formula C2H2 and structure H−C≡C−H. It is a hydrocarbon and the simplest alkyne.[7] This colorless gas is widely used as a fuel and a chemical building block. It is unstable in its pure form and thus is usually handled as a solution.[8] Pure acetylene is odorless, but commercial grades usually have a marked odor due to impurities such as divinyl sulfide and phosphine.[8][9]
As an alkyne, acetylene is unsaturated because its two carbon atoms are bonded together in a triple bond. The carbon–carbon triple bond places all four atoms in the same straight line, with CCH bond angles of 180°.[10]
Discovery[edit]
Acetylene was discovered in 1836 by Edmund Davy, who identified it as a «new carburet of hydrogen».[11][12] It was an accidental discovery while attempting to isolate potassium metal. By heating potassium carbonate with carbon at very high temperatures, he produced a residue of what is now known as potassium carbide, (K2C2), which reacted with water to release the new gas. It was rediscovered in 1860 by French chemist Marcellin Berthelot, who coined the name acétylène.[13] Berthelot’s empirical formula for acetylene (C4H2), as well as the alternative name «quadricarbure d’hydrogène» (hydrogen quadricarbide), were incorrect because many chemists at that time used the wrong atomic mass for carbon (6 instead of 12).[14] Berthelot was able to prepare this gas by passing vapours of organic compounds (methanol, ethanol, etc.) through a red hot tube and collecting the effluent. He also found that acetylene was formed by sparking electricity through mixed cyanogen and hydrogen gases. Berthelot later obtained acetylene directly by passing hydrogen between the poles of a carbon arc.[15][16]
Preparation[edit]
Since the 1950s, acetylene has mainly been manufactured by the partial combustion of methane.[8][17][18] It is a recovered side product in production of ethylene by cracking of hydrocarbons. Approximately 400,000 tonnes were produced by this method in 1983.[8] Its presence in ethylene is usually undesirable because of its explosive character and its ability to poison Ziegler–Natta catalysts. It is selectively hydrogenated into ethylene, usually using Pd–Ag catalysts.[19]
Acetylene factory with annual capacity of 90,000 tons, commissioned in 2020 by BASF.
Until the 1950s, when oil supplanted coal as the chief source of reduced carbon, acetylene (and the aromatic fraction from coal tar) was the main source of organic chemicals in the chemical industry. It was prepared by the hydrolysis of calcium carbide, a reaction discovered by Friedrich Wöhler in 1862[20] and still familiar to students:
Calcium carbide production requires extremely high temperatures, ~2000 °C, necessitating the use of an electric arc furnace. In the US, this process was an important part of the late-19th century revolution in chemistry enabled by the massive hydroelectric power project at Niagara Falls.[21]
Bonding[edit]
In terms of valence bond theory, in each carbon atom the 2s orbital hybridizes with one 2p orbital thus forming an sp hybrid. The other two 2p orbitals remain unhybridized. The two ends of the two sp hybrid orbital overlap to form a strong σ valence bond between the carbons, while on each of the other two ends hydrogen atoms attach also by σ bonds. The two unchanged 2p orbitals form a pair of weaker π bonds.[22]
Since acetylene is a linear symmetrical molecule, it possesses the D∞h point group.[23]
Physical properties[edit]
Changes of state[edit]
At atmospheric pressure, acetylene cannot exist as a liquid and does not have a melting point. The triple point on the phase diagram corresponds to the melting point (−80.8 °C) at the minimal pressure at which liquid acetylene can exist (1.27 atm). At temperatures below the triple point, solid acetylene can change directly to the vapour (gas) by sublimation. The sublimation point at atmospheric pressure is −84.0 °C.[24]
Other[edit]
At room temperature, the solubility of acetylene in acetone is 27.9 g per kg. For the same amount of dimethylformamide (DMF), the solubility is 51 g. At
20.26 bar, the solubility increases to 689.0 and 628.0 g for acetone and DMF, respectively. These solvents are used in pressurized gas cylinders.[25]
Applications[edit]
Welding[edit]
Approximately 20% of acetylene is supplied by the industrial gases industry for oxyacetylene gas welding and cutting due to the high temperature of the flame. Combustion of acetylene with oxygen produces a flame of over 3,600 K (3,330 °C; 6,020 °F), releasing 11.8 kJ/g. Oxyacetylene is the hottest burning common fuel gas.[26] Acetylene is the third-hottest natural chemical flame after dicyanoacetylene’s 5,260 K (4,990 °C; 9,010 °F) and cyanogen at 4,798 K (4,525 °C; 8,177 °F). Oxy-acetylene welding was a popular welding process in previous decades. The development and advantages of arc-based welding processes have made oxy-fuel welding nearly extinct for many applications. Acetylene usage for welding has dropped significantly. On the other hand, oxy-acetylene welding equipment is quite versatile – not only because the torch is preferred for some sorts of iron or steel welding (as in certain artistic applications), but also because it lends itself easily to brazing, braze-welding, metal heating (for annealing or tempering, bending or forming), the loosening of corroded nuts and bolts, and other applications. Bell Canada cable-repair technicians still use portable acetylene-fuelled torch kits as a soldering tool for sealing lead sleeve splices in manholes and in some aerial locations. Oxyacetylene welding may also be used in areas where electricity is not readily accessible. Oxyacetylene cutting is used in many metal fabrication shops. For use in welding and cutting, the working pressures must be controlled by a regulator, since above 15 psi (100 kPa), if subjected to a shockwave (caused, for example, by a flashback), acetylene decomposes explosively into hydrogen and carbon.[27]
Acetylene fuel container/burner as used in the island of Bali
Portable lighting[edit]
Acetylene combustion produces a strong, bright light and the ubiquity of carbide lamps drove much acetylene commercialization in the early 20th century. Common applications included coastal lighthouses,[28] street lights,[29] and automobile[30] and mining headlamps.[31] In most of these applications, direct combustion is a fire hazard, and so acetylene has been replaced, first by incandescent lighting and many years later by low-power/high-lumen LEDs. Nevertheless, acetylene lamps remain in limited use in remote or otherwise inaccessible areas and in countries with a weak or unreliable central electric grid.[31]
Plastics and acrylic acid derivatives[edit]
Acetylene can be semihydrogenated to ethylene, providing a feedstock for a variety of polyethylene plastics. Another major application of acetylene, especially in China is its conversion to acrylic acid derivatives.[8] These derivatives form products such as acrylic fibers, glasses, paints, resins, and polymers.[32]
Except in China, use of acetylene as a chemical feedstock has declined by 70% from 1965 to 2007 owing to cost and environmental considerations.
Niche applications[edit]
In 1881, the Russian chemist Mikhail Kucherov[33] described the hydration of acetylene to acetaldehyde using catalysts such as mercury(II) bromide. Before the advent of the Wacker process, this reaction was conducted on an industrial scale.[34]
The polymerization of acetylene with Ziegler–Natta catalysts produces polyacetylene films. Polyacetylene, a chain of CH centres with alternating single and double bonds, was one of the first discovered organic semiconductors. Its reaction with iodine produces a highly electrically conducting material. Although such materials are not useful, these discoveries led to the developments of organic semiconductors, as recognized by the Nobel Prize in Chemistry in 2000 to Alan J. Heeger, Alan G MacDiarmid, and Hideki Shirakawa.[8]
In the 1920s, pure acetylene was experimentally used as an inhalation anesthetic.[35]
Acetylene is sometimes used for carburization (that is, hardening) of steel when the object is too large to fit into a furnace.[36]
Acetylene is used to volatilize carbon in radiocarbon dating. The carbonaceous material in an archeological sample is treated with lithium metal in a small specialized research furnace to form lithium carbide (also known as lithium acetylide). The carbide can then be reacted with water, as usual, to form acetylene gas to feed into a mass spectrometer to measure the isotopic ratio of carbon-14 to carbon-12.[37]
Natural occurrence[edit]
The energy richness of the C≡C triple bond and the rather high solubility of acetylene in water make it a suitable substrate for bacteria, provided an adequate source is available.[38] A number of bacteria living on acetylene have been identified. The enzyme acetylene hydratase catalyzes the hydration of acetylene to give acetaldehyde:[39]
Acetylene is a moderately common chemical in the universe, often associated with the atmospheres of gas giants.[40] One curious discovery of acetylene is on Enceladus, a moon of Saturn. Natural acetylene is believed to form from catalytic decomposition of long-chain hydrocarbons at temperatures of 1,700 K (1,430 °C; 2,600 °F) and above. Since such temperatures are highly unlikely on such a small distant body, this discovery is potentially suggestive of catalytic reactions within that moon, making it a promising site to search for prebiotic chemistry.[41][42]
Reactions[edit]
Vinylation reactions[edit]
In vinylation reactions, H−X compounds add across the triple bond. Alcohols and phenols add to acetylene to give vinyl ethers. Thiols give vinyl thioethers. Similarly, vinylpyrrolidone and vinylcarbazole are produced industrially by vinylation of 2-pyrrolidone and carbazole.[25][8]
The hydration of acetylene is a vinylation reaction, but the resulting vinyl alcohol isomerizes to acetaldehyde. The reaction is catalyzed by mercury salts. This reaction once was the dominant technology for acetaldehyde production, but it has been displaced by the Wacker process, which affords acetaldehyde by oxidation of ethylene, a cheaper feedstock. A similar situation applies to the conversion of acetylene to the valuable vinyl chloride by hydrochlorination vs the oxychlorination of ethylene.
Ethynylation[edit]
Acetylene adds to aldehydes and ketones to form α-ethynyl alcohols:[8]
The reaction with formaldehyde is used industrially in the production of butynediol, forming propargyl alcohol as the by-product. Copper acetylide is used as the catalyst.[43][44]
Because halogens add across the triple bond, the substituted acetylenes difluoroacetylene, dichloroacetylene, dibromoacetylene, and diiodoacetylene cannot be made directly from acetylene. A common workaround is to dehydrate vinyl dihaloethenols.[45]
Carbonylation[edit]
Walter Reppe discovered that in the presence of catalysts, acetylene reacts to give a wide range of industrially significant chemicals.[8][46][47]
With carbon monoxide, acetylene reacts to give acrylic acid, or acrylic esters, which can be used to produce acrylic glass.[32]
Organometallic chemistry[edit]
Acetylene and its derivatives (2-butyne, diphenylacetylene, etc.) form complexes with transition metals. Its bonding to the metal is somewhat similar to that of ethylene complexes. These complexes are intermediates in many catalytic reactions such as alkyne trimerisation to benzene, tetramerization to cyclooctatetraene,[8] and carbonylation to hydroquinone:[46]
at basic conditions (50–80 °C, 20–25 atm).
In the presence of certain transition metals, alkynes undergo alkyne metathesis.
Metal acetylides, species of the formula LnM−C2R, are also common. Copper(I) acetylide and silver acetylide can be formed in aqueous solutions with ease due to a poor solubility equilibrium.[48]
Acid-base reactions[edit]
Acetylene has a pKa of 25, acetylene can be deprotonated by a superbase to form an acetylide:[48]
Various organometallic[49] and inorganic[50] reagents are effective.
Safety and handling[edit]
Acetylene is not especially toxic, but when generated from calcium carbide, it can contain toxic impurities such as traces of phosphine and arsine, which give it a distinct garlic-like smell. It is also highly flammable, as are most light hydrocarbons, hence its use in welding. Its most singular hazard is associated with its intrinsic instability, especially when it is pressurized: under certain conditions acetylene can react in an exothermic addition-type reaction to form a number of products, typically benzene and/or vinylacetylene, possibly in addition to carbon and hydrogen.[citation needed] Consequently, acetylene, if initiated by intense heat or a shockwave, can decompose explosively if the absolute pressure of the gas exceeds about 200 kilopascals (29 psi). Most regulators and pressure gauges on equipment report gauge pressure, and the safe limit for acetylene therefore is 101 kPagage, or 15 psig.[51][52] It is therefore supplied and stored dissolved in acetone or dimethylformamide (DMF),[52][53][54] contained in a gas cylinder with a porous filling (Agamassan), which renders it safe to transport and use, given proper handling. Acetylene cylinders should be used in the upright position to avoid withdrawing acetone during use.[55]
Information on safe storage of acetylene in upright cylinders is provided by the OSHA,[56][57] Compressed Gas Association,[52] United States Mine Safety and Health Administration (MSHA),[58] EIGA,[55] and other agencies.
Copper catalyses the decomposition of acetylene, and as a result acetylene should not be transported in copper pipes.[59]
Cylinders should be stored in an area segregated from oxidizers to avoid exacerbated reaction in case of fire/leakage.[52][57] Acetylene cylinders should not be stored in confined spaces, enclosed vehicles, garages, and buildings, to avoid unintended leakage leading to explosive atmosphere.[52][57] In the US, National Electric Code (NEC) requires consideration for hazardous areas including those where acetylene may be released during accidents or leaks.[60] Consideration may include electrical classification and use of listed Group A electrical components in USA.[60] Further information on determining the areas requiring special consideration is in NFPA 497.[61] In Europe, ATEX also requires consideration for hazardous areas where flammable gases may be released during accidents or leaks.[55]
References[edit]
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 375. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
The name acetylene is retained for the compound HC≡CH. It is the preferred IUPAC name, but substitution of any kind is not allowed; however, in general nomenclature, substitution is allowed, for example fluoroacetylene [fluoroethyne (PIN)], but not by alkyl groups or any other group that extends the carbon chain, nor by characteristic groups expressed by suffixes.
- ^ Acyclic Hydrocarbons. Rule A-3. Unsaturated Compounds and Univalent Radicals Archived 10 October 2000 at the Wayback Machine, IUPAC Nomenclature of Organic Chemistry
- ^ Record of Acetylene in the GESTIS Substance Database of the Institute for Occupational Safety and Health
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0008». National Institute for Occupational Safety and Health (NIOSH).
- ^ «Acetylene – Gas Encyclopedia Air Liquide». Air Liquide. Archived from the original on 4 May 2022. Retrieved 27 September 2018.
- ^ a b c CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942. Archived from the original on 4 May 2022. Retrieved 4 May 2022.
{{cite book}}: CS1 maint: others (link) - ^ R. H. Petrucci; W. S. Harwood; F. G. Herring (2002). General Chemistry (8th ed.). Prentice-Hall. p. 1072.
- ^ a b c d e f g h i j Pässler, Peter; Hefner, Werner; Buckl, Klaus; Meinass, Helmut; Meiswinkel, Andreas; Wernicke, Hans-Jürgen; Ebersberg, Günter; Müller, Richard; Bässler (2008). «Acetylene Chemistry». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_097.pub3.
- ^ Compressed Gas Association (1995) Material Safety and Data Sheet – Acetylene Archived 11 July 2012 at the Wayback Machine
- ^ Whitten K. W., Gailey K. D. and Davis R. E. General Chemistry (4th ed., Saunders College Publishing 1992), pp. 328–329, 1046. ISBN 0-03-072373-6.
- ^ Edmund Davy (August 1836) «Notice of a new gaseous bicarburet of hydrogen» Archived 6 May 2016 at the Wayback Machine, Report of the Sixth Meeting of the British Association for the Advancement of Science …, 5: 62–63.
- ^ Miller, S. A. (1965). Acetylene: Its Properties, Manufacture and Uses. Vol. 1. Academic Press Inc. Archived from the original on 15 April 2021. Retrieved 16 July 2021.
- ^ Bertholet (1860) «Note sur une nouvelle série de composés organiques, le quadricarbure d’hydrogène et ses dérivés» Archived 13 July 2015 at the Wayback Machine (Note on a new series of organic compounds, tetra-carbon hydride and its derivatives), Comptes rendus, series 3, 50: 805–808.
- ^ Ihde, Aaron J. (1961). «The Karlsruhe Congress: A centennial retrospective». Journal of Chemical Education. 38 (2): 83. Bibcode:1961JChEd..38…83I. doi:10.1021/ed038p83. Archived from the original on 30 December 2021. Retrieved 29 December 2021.
Atomic weights of 6 and 12 were both in use for carbon.
- ^ Berthelot (1862) «Synthèse de l’acétylène par la combinaison directe du carbone avec l’hydrogène» Archived 14 August 2020 at the Wayback Machine (Synthesis of acetylene by the direct combination of carbon with hydrogen), Comptes rendus, series 3, 54: 640–644.
- ^ Acetylene Archived 28 January 2012 at the Wayback Machine.
- ^ Habil, Phil; Sachsse, Hans (1954). «Herstellung von Acetylen durch unvollständige Verbrennung von Kohlenwasserstoffen mit Sauerstoff (Production of acetylene by incomplete combustion of hydrocarbons with oxygen)». Chemie Ingenieur Technik. 26 (5): 245–253. doi:10.1002/cite.330260502.
- ^ Habil, Phil; Bartholoméa, E. (1954). «Probleme großtechnischer Anlagen zur Erzeugung von Acetylen nach dem Sauerstoff-Verfahren (Problems of large-scale plants for the production of acetylene by the oxygen method)». Chemie Ingenieur Technik. 26 (5): 253–258. doi:10.1002/cite.330260503.
- ^ Acetylene: How Products are Made Archived 20 January 2007 at the Wayback Machine
- ^ Wohler (1862) «Bildung des Acetylens durch Kohlenstoffcalcium» Archived 12 May 2016 at the Wayback Machine (Formation of actylene by calcium carbide), Annalen der Chemie und Pharmacie, 124: 220.
- ^ Freeman, Horace (1919). «Manufacture of Cyanamide». The Chemical News and the Journal of Physical Science. 117: 232. Archived from the original on 15 April 2021. Retrieved 23 December 2013.
- ^ Organic Chemistry 7th ed. by J. McMurry, Thomson 2008
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall. pp. 94–95. ISBN 978-0-13-175553-6.
- ^ Handbook of Chemistry and Physics (60th ed., CRC Press 1979–80), p. C-303 in Table Physical Constants of Organic Compounds (listed as ethyne).
- ^ a b Harreus, Albrecht Ludwig; Backes, R.; Eichler, J.-O.; Feuerhake, R.; Jäkel, C.; Mahn, U.; Pinkos, R.; Vogelsang»2-Pyrrolidone, R. (2011). Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_457.pub2.
- ^ «Acetylene». Products and Supply > Fuel Gases. Linde. Archived from the original on 12 January 2018. Retrieved 30 November 2013.
- ^ ESAB Oxy-acetylene welding handbook – Acetylene properties Archived 10 May 2020 at the Wayback Machine.
- ^ «Lighthouse Lamps Through Time by Thomas Tag | US Lighthouse Society». uslhs.org. Archived from the original on 25 February 2017. Retrieved 24 February 2017.
- ^ Myers, Richard L. (2007). The 100 Most Important Chemical Compounds: A Reference Guide. ABC-CLIO. ISBN 978-0-313-33758-1. Archived from the original on 17 June 2016. Retrieved 21 November 2015.
- ^ Grainger, D., (2001). By cars’ early light: A short history of the headlamp: 1900s lights bore port and starboard red and green lenses. National Post. [Toronto Edition] DT7.
- ^ a b Thorpe, Dave (2005). Carbide Light: The Last Flame in American Mines. Bergamot Publishing. ISBN 978-0976090526.
- ^ a b Takashi Ohara; Takahisa Sato; Noboru Shimizu; Günter Prescher; Helmut Schwind; Otto Weiberg; Klaus Marten; Helmut Greim (2003). «Acrylic Acid and Derivatives». Ullmann’s Encyclopedia of Industrial Chemistry: 7. doi:10.1002/14356007.a01_161.pub2. ISBN 3527306730.
- ^ Kutscheroff, M. (1881). «Ueber eine neue Methode direkter Addition von Wasser (Hydratation) an die Kohlenwasserstoffe der Acetylenreihe». Berichte der Deutschen Chemischen Gesellschaft. 14: 1540–1542. doi:10.1002/cber.188101401320. Archived from the original on 2 December 2020. Retrieved 9 September 2019.
- ^ Dmitry A. Ponomarev; Sergey M. Shevchenko (2007). «Hydration of Acetylene: A 125th Anniversary» (PDF). J. Chem. Educ. 84 (10): 1725. Bibcode:2007JChEd..84.1725P. doi:10.1021/ed084p1725. Archived (PDF) from the original on 11 June 2011. Retrieved 18 February 2009.
- ^ William Stanley Sykes (1930). «Acetylene in medicine». Encyclopaedia Britannica. Vol. 1 (14 ed.). p. 119.
- ^ «Acetylene». Products and Services. BOC. Archived from the original on 17 May 2006.
- ^ Geyh, Mebus (1990). «Radiocarbon dating problems using acetylene as counting gas». Radiocarbon. 32 (3): 321–324. doi:10.2458/azu_js_rc.32.1278. Archived from the original on 26 December 2013. Retrieved 26 December 2013.
- ^ Akob, Denise (August 2018). «Acetylenotrophy: a hidden but ubiquitous microbial metabolism?». FEMS Microbiology Ecology. 94 (8). doi:10.1093/femsec/fiy103. PMC 7190893. PMID 29933435. Retrieved 28 July 2022.
- ^ ten Brink, Felix (2014). «Chapter 2. Living on acetylene. A Primordial Energy Source». In Peter M. H. Kroneck and Martha E. Sosa Torres (ed.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 15–35. doi:10.1007/978-94-017-9269-1_2. PMID 25416389.
- ^ «Precursor to Proteins and DNA found in Stellar Disk» (Press release). W. M. Keck Observatory. 20 December 2005. Archived from the original on 23 February 2007.
- ^ Emily Lakdawalla (17 March 2006). «LPSC: Wednesday afternoon: Cassini at Enceladus». The Planetary Society. Archived from the original on 20 February 2012.
- ^ John Spencer; David Grinspoon (25 January 2007). «Planetary science: Inside Enceladus». Nature. 445 (7126): 376–377. Bibcode:2007Natur.445..376S. doi:10.1038/445376b. PMID 17251967. S2CID 4427890.
- ^ Gräfje, Heinz; Körnig, Wolfgang; Weitz, Hans-Martin; Reiß, Wolfgang; Steffan, Guido; Diehl, Herbert; Bosche, Horst; Schneider, Kurt; Kieczka, Heinz (15 June 2000), «Butanediols, Butenediol, and Butynediol», in Wiley-VCH Verlag GmbH & Co. KGaA (ed.), Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, pp. a04_455, doi:10.1002/14356007.a04_455, ISBN 978-3-527-30673-2, S2CID 178601434, archived from the original on 19 March 2022, retrieved 3 March 2022
- ^ Falbe, Jürgen; Bahrmann, Helmut; Lipps, Wolfgang; Mayer, Dieter (15 June 2000), «Alcohols, Aliphatic», in Wiley-VCH Verlag GmbH & Co. KGaA (ed.), Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, pp. a01_279, doi:10.1002/14356007.a01_279, ISBN 978-3-527-30673-2, archived from the original on 9 March 2022, retrieved 3 March 2022
- ^ Kloster-Jenson, Else (1971). «Preparation and physical characterization of pure hetero and homo dihaloacetylenes». Tetrahedron. 27 (1): 33–49. doi:10.1016/S0040-4020(01)92395-6.
- ^ a b Reppe, Walter; Kutepow, N; Magin, A (1969). «Cyclization of Acetylenic Compounds». Angewandte Chemie International Edition in English. 8 (10): 727–733. doi:10.1002/anie.196907271.
- ^ Trotuş, Ioan-Teodor; Zimmermann, Tobias; Schüth, Ferdi (14 November 2013). «Catalytic Reactions of Acetylene: A Feedstock for the Chemical Industry Revisited». Chemical Reviews. 114 (3): 1761–1782. doi:10.1021/cr400357r. PMID 24228942.
- ^ a b Viehe, Heinz Günter (1969). Chemistry of Acetylenes (1st ed.). New York: Marcel Dekker, inc. pp. 170–179 & 225–241. ISBN 978-0824716752.
- ^ Midland, M. M.; McLoughlin, J. I.; Werley, Ralph T. (Jr.) (1990). «Preparation and Use of Lithium Acetylide: 1-Methyl-2-ethynyl-endo-3,3-dimethyl-2-norbornanol». Organic Syntheses. 68: 14. doi:10.15227/orgsyn.068.0014.
- ^ Coffman, Donald D. (1940). «Dimethylethhynylcarbinol». Organic Syntheses. 40: 20. doi:10.15227/orgsyn.020.0040.
- ^ «Acetylene Specification». CFC StarTec LLC. Archived from the original on 11 March 2014. Retrieved 2 May 2012.
- ^ a b c d e «law.resource.org CGA g-1 2009 (incorporated by reference)» (PDF). Archived (PDF) from the original on 10 October 2016. Retrieved 30 November 2016.
- ^ Downie, N. A. (1997). Industrial Gases. London; New York: Blackie Academic & Professional. ISBN 978-0-7514-0352-7.
- ^ Korzun, Mikołaj (1986). 1000 słów o materiałach wybuchowych i wybuchu. Warszawa: Wydawnictwo Ministerstwa Obrony Narodowej. ISBN 83-11-07044-X. OCLC 69535236.
- ^ a b c «EIGA Code of Practice: Acetylene» (PDF). Archived from the original (PDF) on 1 December 2016. Retrieved 30 November 2016.
- ^ «OSHA 29 CFR 1910.102 Acetylene». Archived from the original on 1 December 2016. Retrieved 30 November 2016.
- ^ a b c «OSHA 29 CFR 1926.350 Gas Welding and cutting». Archived from the original on 1 December 2016. Retrieved 30 November 2016.
- ^ Special Hazards of Acetylene Archived 24 March 2016 at the Wayback Machine UNITED STATES DEPARTMENT OF LABOR Mine Safety and Health Administration – MSHA.
- ^ Daniel_Sarachick (16 October 2003). «ACETYLENE SAFETY ALERT» (PDF). Office of Environmental Health & Safety (EHS). Archived (PDF) from the original on 13 July 2018. Retrieved 27 September 2018.
- ^ a b «NFPA free access to 2017 edition of NFPA 70 (NEC)». Archived from the original on 1 December 2016. Retrieved 30 November 2016.
- ^ «NFPA Free Access to NFPA 497 – Recommended Practice for the Classification of Flammable Liquids, Gases, or Vapors and of Hazardous (Classified) Locations for Electrical Installations in Chemical Process Areas». Archived from the original on 1 December 2016. Retrieved 30 November 2016.
External links[edit]
Wikiquote has quotations related to Acetylene.
Wikimedia Commons has media related to Acetylene.
- Acetylene Production Plant and Detailed Process Archived 11 April 2015 at the Wayback Machine
- Acetylene at Chemistry Comes Alive!
- Acetylene, the Principles of Its Generation and Use at Project Gutenberg
- Movie explaining acetylene formation from calcium carbide and the explosive limits forming fire hazards
- Calcium Carbide & Acetylene at The Periodic Table of Videos (University of Nottingham)
- CDC – NIOSH Pocket Guide to Chemical Hazards – Acetylene
«ethyne» redirects here. Not to be confused with ethane or ethene.

|
|

|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Acetylene[1] |
|
| Systematic IUPAC name
Ethyne[2] |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
|
Beilstein Reference |
906677 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.000.743 |
| EC Number |
|
|
Gmelin Reference |
210 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1001 (dissolved) 3138 (in mixture with ethylene and propylene) |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C2H2 |
| Molar mass | 26.038 g·mol−1 |
| Appearance | Colorless gas |
| Odor | Odorless |
| Density | 1.1772 g/L = 1.1772 kg/m3 (0 °C, 101.3 kPa)[3] |
| Melting point | −80.8 °C (−113.4 °F; 192.3 K) Triple point at 1.27 atm |
|
Sublimation |
−84 °C; −119 °F; 189 K (1 atm) |
|
Solubility in water |
slightly soluble |
| Solubility | slightly soluble in alcohol soluble in acetone, benzene |
| Vapor pressure | 44.2 atm (20 °C)[4] |
| Acidity (pKa) | 25[5] |
| Conjugate acid | Ethynium |
|
Magnetic susceptibility (χ) |
−20.8×10−6 cm3/mol [6] |
| Thermal conductivity | 21.4 mW·m−1·K−1 (300 K) [6] |
| Structure | |
|
Molecular shape |
Linear |
| Thermochemistry[6] | |
|
Heat capacity (C) |
44.036 J·mol−1·K−1 |
|
Std molar |
200.927 J·mol−1·K−1 |
|
Std enthalpy of |
227.400 kJ·mol−1 |
|
Gibbs free energy (ΔfG⦵) |
209.879 kJ·mol−1 |
|
Std enthalpy of |
1300 kJ·mol−1 |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H220, H336 |
|
Precautionary statements |
P202, P210, P233, P261, P271, P304, P312, P340, P377, P381, P403, P405, P501 |
| NFPA 704 (fire diamond) |
1 4 3 |
|
Autoignition |
300 °C (572 °F; 573 K) |
| Explosive limits | 2.5–100% |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
none[4] |
|
REL (Recommended) |
C 2500 ppm (2662 mg/m3)[4] |
|
IDLH (Immediate danger) |
N.D.[4] |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Acetylene (systematic name: ethyne) is the chemical compound with the formula C2H2 and structure H−C≡C−H. It is a hydrocarbon and the simplest alkyne.[7] This colorless gas is widely used as a fuel and a chemical building block. It is unstable in its pure form and thus is usually handled as a solution.[8] Pure acetylene is odorless, but commercial grades usually have a marked odor due to impurities such as divinyl sulfide and phosphine.[8][9]
As an alkyne, acetylene is unsaturated because its two carbon atoms are bonded together in a triple bond. The carbon–carbon triple bond places all four atoms in the same straight line, with CCH bond angles of 180°.[10]
Discovery[edit]
Acetylene was discovered in 1836 by Edmund Davy, who identified it as a «new carburet of hydrogen».[11][12] It was an accidental discovery while attempting to isolate potassium metal. By heating potassium carbonate with carbon at very high temperatures, he produced a residue of what is now known as potassium carbide, (K2C2), which reacted with water to release the new gas. It was rediscovered in 1860 by French chemist Marcellin Berthelot, who coined the name acétylène.[13] Berthelot’s empirical formula for acetylene (C4H2), as well as the alternative name «quadricarbure d’hydrogène» (hydrogen quadricarbide), were incorrect because many chemists at that time used the wrong atomic mass for carbon (6 instead of 12).[14] Berthelot was able to prepare this gas by passing vapours of organic compounds (methanol, ethanol, etc.) through a red hot tube and collecting the effluent. He also found that acetylene was formed by sparking electricity through mixed cyanogen and hydrogen gases. Berthelot later obtained acetylene directly by passing hydrogen between the poles of a carbon arc.[15][16]
Preparation[edit]
Since the 1950s, acetylene has mainly been manufactured by the partial combustion of methane.[8][17][18] It is a recovered side product in production of ethylene by cracking of hydrocarbons. Approximately 400,000 tonnes were produced by this method in 1983.[8] Its presence in ethylene is usually undesirable because of its explosive character and its ability to poison Ziegler–Natta catalysts. It is selectively hydrogenated into ethylene, usually using Pd–Ag catalysts.[19]
Acetylene factory with annual capacity of 90,000 tons, commissioned in 2020 by BASF.
Until the 1950s, when oil supplanted coal as the chief source of reduced carbon, acetylene (and the aromatic fraction from coal tar) was the main source of organic chemicals in the chemical industry. It was prepared by the hydrolysis of calcium carbide, a reaction discovered by Friedrich Wöhler in 1862[20] and still familiar to students:
Calcium carbide production requires extremely high temperatures, ~2000 °C, necessitating the use of an electric arc furnace. In the US, this process was an important part of the late-19th century revolution in chemistry enabled by the massive hydroelectric power project at Niagara Falls.[21]
Bonding[edit]
In terms of valence bond theory, in each carbon atom the 2s orbital hybridizes with one 2p orbital thus forming an sp hybrid. The other two 2p orbitals remain unhybridized. The two ends of the two sp hybrid orbital overlap to form a strong σ valence bond between the carbons, while on each of the other two ends hydrogen atoms attach also by σ bonds. The two unchanged 2p orbitals form a pair of weaker π bonds.[22]
Since acetylene is a linear symmetrical molecule, it possesses the D∞h point group.[23]
Physical properties[edit]
Changes of state[edit]
At atmospheric pressure, acetylene cannot exist as a liquid and does not have a melting point. The triple point on the phase diagram corresponds to the melting point (−80.8 °C) at the minimal pressure at which liquid acetylene can exist (1.27 atm). At temperatures below the triple point, solid acetylene can change directly to the vapour (gas) by sublimation. The sublimation point at atmospheric pressure is −84.0 °C.[24]
Other[edit]
At room temperature, the solubility of acetylene in acetone is 27.9 g per kg. For the same amount of dimethylformamide (DMF), the solubility is 51 g. At
20.26 bar, the solubility increases to 689.0 and 628.0 g for acetone and DMF, respectively. These solvents are used in pressurized gas cylinders.[25]
Applications[edit]
Welding[edit]
Approximately 20% of acetylene is supplied by the industrial gases industry for oxyacetylene gas welding and cutting due to the high temperature of the flame. Combustion of acetylene with oxygen produces a flame of over 3,600 K (3,330 °C; 6,020 °F), releasing 11.8 kJ/g. Oxyacetylene is the hottest burning common fuel gas.[26] Acetylene is the third-hottest natural chemical flame after dicyanoacetylene’s 5,260 K (4,990 °C; 9,010 °F) and cyanogen at 4,798 K (4,525 °C; 8,177 °F). Oxy-acetylene welding was a popular welding process in previous decades. The development and advantages of arc-based welding processes have made oxy-fuel welding nearly extinct for many applications. Acetylene usage for welding has dropped significantly. On the other hand, oxy-acetylene welding equipment is quite versatile – not only because the torch is preferred for some sorts of iron or steel welding (as in certain artistic applications), but also because it lends itself easily to brazing, braze-welding, metal heating (for annealing or tempering, bending or forming), the loosening of corroded nuts and bolts, and other applications. Bell Canada cable-repair technicians still use portable acetylene-fuelled torch kits as a soldering tool for sealing lead sleeve splices in manholes and in some aerial locations. Oxyacetylene welding may also be used in areas where electricity is not readily accessible. Oxyacetylene cutting is used in many metal fabrication shops. For use in welding and cutting, the working pressures must be controlled by a regulator, since above 15 psi (100 kPa), if subjected to a shockwave (caused, for example, by a flashback), acetylene decomposes explosively into hydrogen and carbon.[27]
Acetylene fuel container/burner as used in the island of Bali
Portable lighting[edit]
Acetylene combustion produces a strong, bright light and the ubiquity of carbide lamps drove much acetylene commercialization in the early 20th century. Common applications included coastal lighthouses,[28] street lights,[29] and automobile[30] and mining headlamps.[31] In most of these applications, direct combustion is a fire hazard, and so acetylene has been replaced, first by incandescent lighting and many years later by low-power/high-lumen LEDs. Nevertheless, acetylene lamps remain in limited use in remote or otherwise inaccessible areas and in countries with a weak or unreliable central electric grid.[31]
Plastics and acrylic acid derivatives[edit]
Acetylene can be semihydrogenated to ethylene, providing a feedstock for a variety of polyethylene plastics. Another major application of acetylene, especially in China is its conversion to acrylic acid derivatives.[8] These derivatives form products such as acrylic fibers, glasses, paints, resins, and polymers.[32]
Except in China, use of acetylene as a chemical feedstock has declined by 70% from 1965 to 2007 owing to cost and environmental considerations.
Niche applications[edit]
In 1881, the Russian chemist Mikhail Kucherov[33] described the hydration of acetylene to acetaldehyde using catalysts such as mercury(II) bromide. Before the advent of the Wacker process, this reaction was conducted on an industrial scale.[34]
The polymerization of acetylene with Ziegler–Natta catalysts produces polyacetylene films. Polyacetylene, a chain of CH centres with alternating single and double bonds, was one of the first discovered organic semiconductors. Its reaction with iodine produces a highly electrically conducting material. Although such materials are not useful, these discoveries led to the developments of organic semiconductors, as recognized by the Nobel Prize in Chemistry in 2000 to Alan J. Heeger, Alan G MacDiarmid, and Hideki Shirakawa.[8]
In the 1920s, pure acetylene was experimentally used as an inhalation anesthetic.[35]
Acetylene is sometimes used for carburization (that is, hardening) of steel when the object is too large to fit into a furnace.[36]
Acetylene is used to volatilize carbon in radiocarbon dating. The carbonaceous material in an archeological sample is treated with lithium metal in a small specialized research furnace to form lithium carbide (also known as lithium acetylide). The carbide can then be reacted with water, as usual, to form acetylene gas to feed into a mass spectrometer to measure the isotopic ratio of carbon-14 to carbon-12.[37]
Natural occurrence[edit]
The energy richness of the C≡C triple bond and the rather high solubility of acetylene in water make it a suitable substrate for bacteria, provided an adequate source is available.[38] A number of bacteria living on acetylene have been identified. The enzyme acetylene hydratase catalyzes the hydration of acetylene to give acetaldehyde:[39]
Acetylene is a moderately common chemical in the universe, often associated with the atmospheres of gas giants.[40] One curious discovery of acetylene is on Enceladus, a moon of Saturn. Natural acetylene is believed to form from catalytic decomposition of long-chain hydrocarbons at temperatures of 1,700 K (1,430 °C; 2,600 °F) and above. Since such temperatures are highly unlikely on such a small distant body, this discovery is potentially suggestive of catalytic reactions within that moon, making it a promising site to search for prebiotic chemistry.[41][42]
Reactions[edit]
Vinylation reactions[edit]
In vinylation reactions, H−X compounds add across the triple bond. Alcohols and phenols add to acetylene to give vinyl ethers. Thiols give vinyl thioethers. Similarly, vinylpyrrolidone and vinylcarbazole are produced industrially by vinylation of 2-pyrrolidone and carbazole.[25][8]
The hydration of acetylene is a vinylation reaction, but the resulting vinyl alcohol isomerizes to acetaldehyde. The reaction is catalyzed by mercury salts. This reaction once was the dominant technology for acetaldehyde production, but it has been displaced by the Wacker process, which affords acetaldehyde by oxidation of ethylene, a cheaper feedstock. A similar situation applies to the conversion of acetylene to the valuable vinyl chloride by hydrochlorination vs the oxychlorination of ethylene.
Ethynylation[edit]
Acetylene adds to aldehydes and ketones to form α-ethynyl alcohols:[8]
The reaction with formaldehyde is used industrially in the production of butynediol, forming propargyl alcohol as the by-product. Copper acetylide is used as the catalyst.[43][44]
Because halogens add across the triple bond, the substituted acetylenes difluoroacetylene, dichloroacetylene, dibromoacetylene, and diiodoacetylene cannot be made directly from acetylene. A common workaround is to dehydrate vinyl dihaloethenols.[45]
Carbonylation[edit]
Walter Reppe discovered that in the presence of catalysts, acetylene reacts to give a wide range of industrially significant chemicals.[8][46][47]
With carbon monoxide, acetylene reacts to give acrylic acid, or acrylic esters, which can be used to produce acrylic glass.[32]
Organometallic chemistry[edit]
Acetylene and its derivatives (2-butyne, diphenylacetylene, etc.) form complexes with transition metals. Its bonding to the metal is somewhat similar to that of ethylene complexes. These complexes are intermediates in many catalytic reactions such as alkyne trimerisation to benzene, tetramerization to cyclooctatetraene,[8] and carbonylation to hydroquinone:[46]
at basic conditions (50–80 °C, 20–25 atm).
In the presence of certain transition metals, alkynes undergo alkyne metathesis.
Metal acetylides, species of the formula LnM−C2R, are also common. Copper(I) acetylide and silver acetylide can be formed in aqueous solutions with ease due to a poor solubility equilibrium.[48]
Acid-base reactions[edit]
Acetylene has a pKa of 25, acetylene can be deprotonated by a superbase to form an acetylide:[48]
Various organometallic[49] and inorganic[50] reagents are effective.
Safety and handling[edit]
Acetylene is not especially toxic, but when generated from calcium carbide, it can contain toxic impurities such as traces of phosphine and arsine, which give it a distinct garlic-like smell. It is also highly flammable, as are most light hydrocarbons, hence its use in welding. Its most singular hazard is associated with its intrinsic instability, especially when it is pressurized: under certain conditions acetylene can react in an exothermic addition-type reaction to form a number of products, typically benzene and/or vinylacetylene, possibly in addition to carbon and hydrogen.[citation needed] Consequently, acetylene, if initiated by intense heat or a shockwave, can decompose explosively if the absolute pressure of the gas exceeds about 200 kilopascals (29 psi). Most regulators and pressure gauges on equipment report gauge pressure, and the safe limit for acetylene therefore is 101 kPagage, or 15 psig.[51][52] It is therefore supplied and stored dissolved in acetone or dimethylformamide (DMF),[52][53][54] contained in a gas cylinder with a porous filling (Agamassan), which renders it safe to transport and use, given proper handling. Acetylene cylinders should be used in the upright position to avoid withdrawing acetone during use.[55]
Information on safe storage of acetylene in upright cylinders is provided by the OSHA,[56][57] Compressed Gas Association,[52] United States Mine Safety and Health Administration (MSHA),[58] EIGA,[55] and other agencies.
Copper catalyses the decomposition of acetylene, and as a result acetylene should not be transported in copper pipes.[59]
Cylinders should be stored in an area segregated from oxidizers to avoid exacerbated reaction in case of fire/leakage.[52][57] Acetylene cylinders should not be stored in confined spaces, enclosed vehicles, garages, and buildings, to avoid unintended leakage leading to explosive atmosphere.[52][57] In the US, National Electric Code (NEC) requires consideration for hazardous areas including those where acetylene may be released during accidents or leaks.[60] Consideration may include electrical classification and use of listed Group A electrical components in USA.[60] Further information on determining the areas requiring special consideration is in NFPA 497.[61] In Europe, ATEX also requires consideration for hazardous areas where flammable gases may be released during accidents or leaks.[55]
References[edit]
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 375. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
The name acetylene is retained for the compound HC≡CH. It is the preferred IUPAC name, but substitution of any kind is not allowed; however, in general nomenclature, substitution is allowed, for example fluoroacetylene [fluoroethyne (PIN)], but not by alkyl groups or any other group that extends the carbon chain, nor by characteristic groups expressed by suffixes.
- ^ Acyclic Hydrocarbons. Rule A-3. Unsaturated Compounds and Univalent Radicals Archived 10 October 2000 at the Wayback Machine, IUPAC Nomenclature of Organic Chemistry
- ^ Record of Acetylene in the GESTIS Substance Database of the Institute for Occupational Safety and Health
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0008». National Institute for Occupational Safety and Health (NIOSH).
- ^ «Acetylene – Gas Encyclopedia Air Liquide». Air Liquide. Archived from the original on 4 May 2022. Retrieved 27 September 2018.
- ^ a b c CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942. Archived from the original on 4 May 2022. Retrieved 4 May 2022.
{{cite book}}: CS1 maint: others (link) - ^ R. H. Petrucci; W. S. Harwood; F. G. Herring (2002). General Chemistry (8th ed.). Prentice-Hall. p. 1072.
- ^ a b c d e f g h i j Pässler, Peter; Hefner, Werner; Buckl, Klaus; Meinass, Helmut; Meiswinkel, Andreas; Wernicke, Hans-Jürgen; Ebersberg, Günter; Müller, Richard; Bässler (2008). «Acetylene Chemistry». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_097.pub3.
- ^ Compressed Gas Association (1995) Material Safety and Data Sheet – Acetylene Archived 11 July 2012 at the Wayback Machine
- ^ Whitten K. W., Gailey K. D. and Davis R. E. General Chemistry (4th ed., Saunders College Publishing 1992), pp. 328–329, 1046. ISBN 0-03-072373-6.
- ^ Edmund Davy (August 1836) «Notice of a new gaseous bicarburet of hydrogen» Archived 6 May 2016 at the Wayback Machine, Report of the Sixth Meeting of the British Association for the Advancement of Science …, 5: 62–63.
- ^ Miller, S. A. (1965). Acetylene: Its Properties, Manufacture and Uses. Vol. 1. Academic Press Inc. Archived from the original on 15 April 2021. Retrieved 16 July 2021.
- ^ Bertholet (1860) «Note sur une nouvelle série de composés organiques, le quadricarbure d’hydrogène et ses dérivés» Archived 13 July 2015 at the Wayback Machine (Note on a new series of organic compounds, tetra-carbon hydride and its derivatives), Comptes rendus, series 3, 50: 805–808.
- ^ Ihde, Aaron J. (1961). «The Karlsruhe Congress: A centennial retrospective». Journal of Chemical Education. 38 (2): 83. Bibcode:1961JChEd..38…83I. doi:10.1021/ed038p83. Archived from the original on 30 December 2021. Retrieved 29 December 2021.
Atomic weights of 6 and 12 were both in use for carbon.
- ^ Berthelot (1862) «Synthèse de l’acétylène par la combinaison directe du carbone avec l’hydrogène» Archived 14 August 2020 at the Wayback Machine (Synthesis of acetylene by the direct combination of carbon with hydrogen), Comptes rendus, series 3, 54: 640–644.
- ^ Acetylene Archived 28 January 2012 at the Wayback Machine.
- ^ Habil, Phil; Sachsse, Hans (1954). «Herstellung von Acetylen durch unvollständige Verbrennung von Kohlenwasserstoffen mit Sauerstoff (Production of acetylene by incomplete combustion of hydrocarbons with oxygen)». Chemie Ingenieur Technik. 26 (5): 245–253. doi:10.1002/cite.330260502.
- ^ Habil, Phil; Bartholoméa, E. (1954). «Probleme großtechnischer Anlagen zur Erzeugung von Acetylen nach dem Sauerstoff-Verfahren (Problems of large-scale plants for the production of acetylene by the oxygen method)». Chemie Ingenieur Technik. 26 (5): 253–258. doi:10.1002/cite.330260503.
- ^ Acetylene: How Products are Made Archived 20 January 2007 at the Wayback Machine
- ^ Wohler (1862) «Bildung des Acetylens durch Kohlenstoffcalcium» Archived 12 May 2016 at the Wayback Machine (Formation of actylene by calcium carbide), Annalen der Chemie und Pharmacie, 124: 220.
- ^ Freeman, Horace (1919). «Manufacture of Cyanamide». The Chemical News and the Journal of Physical Science. 117: 232. Archived from the original on 15 April 2021. Retrieved 23 December 2013.
- ^ Organic Chemistry 7th ed. by J. McMurry, Thomson 2008
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall. pp. 94–95. ISBN 978-0-13-175553-6.
- ^ Handbook of Chemistry and Physics (60th ed., CRC Press 1979–80), p. C-303 in Table Physical Constants of Organic Compounds (listed as ethyne).
- ^ a b Harreus, Albrecht Ludwig; Backes, R.; Eichler, J.-O.; Feuerhake, R.; Jäkel, C.; Mahn, U.; Pinkos, R.; Vogelsang»2-Pyrrolidone, R. (2011). Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_457.pub2.
- ^ «Acetylene». Products and Supply > Fuel Gases. Linde. Archived from the original on 12 January 2018. Retrieved 30 November 2013.
- ^ ESAB Oxy-acetylene welding handbook – Acetylene properties Archived 10 May 2020 at the Wayback Machine.
- ^ «Lighthouse Lamps Through Time by Thomas Tag | US Lighthouse Society». uslhs.org. Archived from the original on 25 February 2017. Retrieved 24 February 2017.
- ^ Myers, Richard L. (2007). The 100 Most Important Chemical Compounds: A Reference Guide. ABC-CLIO. ISBN 978-0-313-33758-1. Archived from the original on 17 June 2016. Retrieved 21 November 2015.
- ^ Grainger, D., (2001). By cars’ early light: A short history of the headlamp: 1900s lights bore port and starboard red and green lenses. National Post. [Toronto Edition] DT7.
- ^ a b Thorpe, Dave (2005). Carbide Light: The Last Flame in American Mines. Bergamot Publishing. ISBN 978-0976090526.
- ^ a b Takashi Ohara; Takahisa Sato; Noboru Shimizu; Günter Prescher; Helmut Schwind; Otto Weiberg; Klaus Marten; Helmut Greim (2003). «Acrylic Acid and Derivatives». Ullmann’s Encyclopedia of Industrial Chemistry: 7. doi:10.1002/14356007.a01_161.pub2. ISBN 3527306730.
- ^ Kutscheroff, M. (1881). «Ueber eine neue Methode direkter Addition von Wasser (Hydratation) an die Kohlenwasserstoffe der Acetylenreihe». Berichte der Deutschen Chemischen Gesellschaft. 14: 1540–1542. doi:10.1002/cber.188101401320. Archived from the original on 2 December 2020. Retrieved 9 September 2019.
- ^ Dmitry A. Ponomarev; Sergey M. Shevchenko (2007). «Hydration of Acetylene: A 125th Anniversary» (PDF). J. Chem. Educ. 84 (10): 1725. Bibcode:2007JChEd..84.1725P. doi:10.1021/ed084p1725. Archived (PDF) from the original on 11 June 2011. Retrieved 18 February 2009.
- ^ William Stanley Sykes (1930). «Acetylene in medicine». Encyclopaedia Britannica. Vol. 1 (14 ed.). p. 119.
- ^ «Acetylene». Products and Services. BOC. Archived from the original on 17 May 2006.
- ^ Geyh, Mebus (1990). «Radiocarbon dating problems using acetylene as counting gas». Radiocarbon. 32 (3): 321–324. doi:10.2458/azu_js_rc.32.1278. Archived from the original on 26 December 2013. Retrieved 26 December 2013.
- ^ Akob, Denise (August 2018). «Acetylenotrophy: a hidden but ubiquitous microbial metabolism?». FEMS Microbiology Ecology. 94 (8). doi:10.1093/femsec/fiy103. PMC 7190893. PMID 29933435. Retrieved 28 July 2022.
- ^ ten Brink, Felix (2014). «Chapter 2. Living on acetylene. A Primordial Energy Source». In Peter M. H. Kroneck and Martha E. Sosa Torres (ed.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 15–35. doi:10.1007/978-94-017-9269-1_2. PMID 25416389.
- ^ «Precursor to Proteins and DNA found in Stellar Disk» (Press release). W. M. Keck Observatory. 20 December 2005. Archived from the original on 23 February 2007.
- ^ Emily Lakdawalla (17 March 2006). «LPSC: Wednesday afternoon: Cassini at Enceladus». The Planetary Society. Archived from the original on 20 February 2012.
- ^ John Spencer; David Grinspoon (25 January 2007). «Planetary science: Inside Enceladus». Nature. 445 (7126): 376–377. Bibcode:2007Natur.445..376S. doi:10.1038/445376b. PMID 17251967. S2CID 4427890.
- ^ Gräfje, Heinz; Körnig, Wolfgang; Weitz, Hans-Martin; Reiß, Wolfgang; Steffan, Guido; Diehl, Herbert; Bosche, Horst; Schneider, Kurt; Kieczka, Heinz (15 June 2000), «Butanediols, Butenediol, and Butynediol», in Wiley-VCH Verlag GmbH & Co. KGaA (ed.), Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, pp. a04_455, doi:10.1002/14356007.a04_455, ISBN 978-3-527-30673-2, S2CID 178601434, archived from the original on 19 March 2022, retrieved 3 March 2022
- ^ Falbe, Jürgen; Bahrmann, Helmut; Lipps, Wolfgang; Mayer, Dieter (15 June 2000), «Alcohols, Aliphatic», in Wiley-VCH Verlag GmbH & Co. KGaA (ed.), Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, pp. a01_279, doi:10.1002/14356007.a01_279, ISBN 978-3-527-30673-2, archived from the original on 9 March 2022, retrieved 3 March 2022
- ^ Kloster-Jenson, Else (1971). «Preparation and physical characterization of pure hetero and homo dihaloacetylenes». Tetrahedron. 27 (1): 33–49. doi:10.1016/S0040-4020(01)92395-6.
- ^ a b Reppe, Walter; Kutepow, N; Magin, A (1969). «Cyclization of Acetylenic Compounds». Angewandte Chemie International Edition in English. 8 (10): 727–733. doi:10.1002/anie.196907271.
- ^ Trotuş, Ioan-Teodor; Zimmermann, Tobias; Schüth, Ferdi (14 November 2013). «Catalytic Reactions of Acetylene: A Feedstock for the Chemical Industry Revisited». Chemical Reviews. 114 (3): 1761–1782. doi:10.1021/cr400357r. PMID 24228942.
- ^ a b Viehe, Heinz Günter (1969). Chemistry of Acetylenes (1st ed.). New York: Marcel Dekker, inc. pp. 170–179 & 225–241. ISBN 978-0824716752.
- ^ Midland, M. M.; McLoughlin, J. I.; Werley, Ralph T. (Jr.) (1990). «Preparation and Use of Lithium Acetylide: 1-Methyl-2-ethynyl-endo-3,3-dimethyl-2-norbornanol». Organic Syntheses. 68: 14. doi:10.15227/orgsyn.068.0014.
- ^ Coffman, Donald D. (1940). «Dimethylethhynylcarbinol». Organic Syntheses. 40: 20. doi:10.15227/orgsyn.020.0040.
- ^ «Acetylene Specification». CFC StarTec LLC. Archived from the original on 11 March 2014. Retrieved 2 May 2012.
- ^ a b c d e «law.resource.org CGA g-1 2009 (incorporated by reference)» (PDF). Archived (PDF) from the original on 10 October 2016. Retrieved 30 November 2016.
- ^ Downie, N. A. (1997). Industrial Gases. London; New York: Blackie Academic & Professional. ISBN 978-0-7514-0352-7.
- ^ Korzun, Mikołaj (1986). 1000 słów o materiałach wybuchowych i wybuchu. Warszawa: Wydawnictwo Ministerstwa Obrony Narodowej. ISBN 83-11-07044-X. OCLC 69535236.
- ^ a b c «EIGA Code of Practice: Acetylene» (PDF). Archived from the original (PDF) on 1 December 2016. Retrieved 30 November 2016.
- ^ «OSHA 29 CFR 1910.102 Acetylene». Archived from the original on 1 December 2016. Retrieved 30 November 2016.
- ^ a b c «OSHA 29 CFR 1926.350 Gas Welding and cutting». Archived from the original on 1 December 2016. Retrieved 30 November 2016.
- ^ Special Hazards of Acetylene Archived 24 March 2016 at the Wayback Machine UNITED STATES DEPARTMENT OF LABOR Mine Safety and Health Administration – MSHA.
- ^ Daniel_Sarachick (16 October 2003). «ACETYLENE SAFETY ALERT» (PDF). Office of Environmental Health & Safety (EHS). Archived (PDF) from the original on 13 July 2018. Retrieved 27 September 2018.
- ^ a b «NFPA free access to 2017 edition of NFPA 70 (NEC)». Archived from the original on 1 December 2016. Retrieved 30 November 2016.
- ^ «NFPA Free Access to NFPA 497 – Recommended Practice for the Classification of Flammable Liquids, Gases, or Vapors and of Hazardous (Classified) Locations for Electrical Installations in Chemical Process Areas». Archived from the original on 1 December 2016. Retrieved 30 November 2016.
External links[edit]
Wikiquote has quotations related to Acetylene.
Wikimedia Commons has media related to Acetylene.
- Acetylene Production Plant and Detailed Process Archived 11 April 2015 at the Wayback Machine
- Acetylene at Chemistry Comes Alive!
- Acetylene, the Principles of Its Generation and Use at Project Gutenberg
- Movie explaining acetylene formation from calcium carbide and the explosive limits forming fire hazards
- Calcium Carbide & Acetylene at The Periodic Table of Videos (University of Nottingham)
- CDC – NIOSH Pocket Guide to Chemical Hazards – Acetylene
«HCCH» перенаправляется сюда. Для использования в других целях см. HCCH (значения).
 |
|
 |
|
 |
|
| Имена | |
|---|---|
| Предпочтительное название IUPAC
Ацетилен[1] |
|
| Систематическое название ИЮПАК
Ethyne[2] |
|
| Идентификаторы | |
|
Количество CAS |
|
|
3D модель (JSmol ) |
|
|
Ссылка на Beilstein |
906677 |
| ЧЭБИ |
|
| ЧЭМБЛ |
|
| ChemSpider |
|
| ECHA InfoCard | 100.000.743 |
| Номер ЕС |
|
|
Ссылка на Гмелин |
210 |
| КЕГГ |
|
|
PubChem CID |
|
| Номер RTECS |
|
| UNII |
|
| Номер ООН | 1001 (растворенный) 3138 (в смеси с этилен и пропилен ) |
|
Панель управления CompTox (EPA) |
|
|
ИнЧИ
|
|
|
Улыбки
|
|
| Характеристики | |
|
Химическая формула |
C2ЧАС2 |
| Молярная масса | 26.038 г · моль−1 |
| Внешность | Бесцветный газ |
| Запах | Без запаха |
| Плотность | 1,097 г / л = 1,097 кг / м3 |
| Температура плавления | -80,8 ° С (-113,4 ° F, 192,3 К) Тройная точка при 1,27 атм |
|
Сублимация |
-84 ° С; -119 ° F; 189 К (1 атм) |
|
Растворимость в воде |
слабо растворимый |
| Давление газа | 44,2 атм (20 ° С)[3] |
| Кислотность (пKа) | 25[4] |
| Конъюгированная кислота | Этиний |
|
Магнитная восприимчивость (χ) |
−12.5×10−6 см3/ моль |
| Структура | |
|
Молекулярная форма |
Линейный |
| Термохимия | |
|
Стандартный моляр |
201 Дж / (моль · К) |
|
Станд. Энтальпия |
+226,88 кДж / моль |
| Опасности | |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
|
Положения об опасности GHS |
H220, H336 |
|
Меры предосторожности GHS |
P202, P210, P261, P271, P304, P340, P312, P377, P381, P403, P403, P233, P405, P501 |
| NFPA 704 (огненный алмаз) |
4 1 3 |
|
Самовоспламенение |
300 ° С (572 ° F, 573 К) |
| NIOSH (Пределы воздействия на здоровье в США): | |
|
PEL (Допустимо) |
никто[3] |
|
REL (Рекомендуемые) |
C 2500 частей на миллион (2662 мг / м3)[3] |
|
IDLH (Непосредственная опасность) |
N.D.[3] |
|
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). |
|
| Ссылки на инфобоксы | |
Ацетилен (систематическое название: этин) это химическое соединение с формулой C2ЧАС2. Это углеводород и самый простой алкин.[5] Этот бесцветный газ (низшие углеводороды, как правило, газообразны) широко используется в качестве топлива и химического строительного блока. В чистом виде он нестабилен, поэтому с ним обычно обращаются как с раствором.[6] Чистый ацетилен не имеет запаха, но коммерческие сорта обычно имеют сильный запах из-за примесей.[7]
Как алкин, ацетилен ненасыщенный потому что его два атома углерода связанный вместе в тройная связь. Тройная связь углерод-углерод помещает все четыре атома на одну прямую с валентным углом CCH 180 °.[8]
Открытие
Ацетилен был открыт в 1836 г. Эдмунд Дэви, которые идентифицировали его как «новый карбюратор водорода».[9][10] Это было случайное открытие при попытке изолировать калий металл. Нагревая карбонат калия с углеродом при очень высоких температурах, он получил остаток того, что теперь известно как карбид калия (K2C2), который вступил в реакцию с водой и выпустил новый газ. Он был заново открыт в 1860 году французским химиком. Марселлен Бертло, кто придумал название ацетилен.[11]Эмпирическая формула Бертло для ацетилена (C4ЧАС2), а также альтернативное название «quadricarbure d’hydrogène» (квадрикарбид водорода), были неправильными, потому что химики в то время использовали неправильную атомную массу для углерода (6 вместо 12).[нужна цитата ]Бертло смог приготовить этот газ, пропуская пары органических соединений (метанол, этанол и т. Д.) Через красную горячую трубку и собирая сточные воды. Он также обнаружил, что ацетилен образуется в результате искрения электричества через смешанные циан и водород газы. Позже Бертло получил ацетилен, пропуская водород между полюсами угольная дуга.[12][13] Имеющийся в продаже газообразный ацетилен может нести запах примесей. дивинилсульфид и фосфин.[6]
Подготовка
С 1950-х годов ацетилен в основном производился на частичных горение из метан.[6][14][15] Это рекуперированный побочный продукт при производстве этилен к треск из углеводороды. В 1983 году этим методом было произведено около 400000 тонн.[6] Его присутствие в этилене обычно нежелательно из-за его взрывоопасности и способности отравлять Катализаторы Циглера – Натта. Он селективно гидрируется в этилен, обычно с использованием катализаторов Pd – Ag.[16]
До 1950-х годов, когда масло вытеснен каменный уголь как главный источник уменьшенный углерод, ацетилен (и ароматическая фракция из каменноугольная смола ) был основным источником органических химикатов в химической промышленности. Он был подготовлен гидролиз из карбид кальция, реакция обнаружена Фридрих Вёлер в 1862 г.[17] и до сих пор знакомые студентам:
- CaC2 + 2H2О → Са (ОН)2 + C2ЧАС2
Производство карбида кальция требует чрезвычайно высоких температур, ~ 2000 ° C, что требует использования электродуговая печь. В США этот процесс был важной частью химической революции конца 19 века, которая стала возможной благодаря гидроэлектростанция проект в Ниагарский водопад.[18]
ИЗ КАРБИДА КАЛЬЦИЯ. Поместите несколько небольших комков карбида кальция (около 15 г) в перегонную колбу на 150 мл (или в колбу Бюхнера аналогичной емкости) и поместите в горлышко колбы высокую капельную воронку. стержень которого вытянут до тонкой точки: стержень должен проходить глубоко под боковым плечом колбы. Подсоедините этот боковой рычаг к промывочной емкости, содержащей 10% водный раствор сульфата меди: таким образом, требуется высокая капельная воронка для создания достаточного «напора» воды в воронке для проталкивания ацетилена через промывочную бутыль. Затем установите на промывочную бутыль подающую трубку, которая точно проходит в пневматический желоб. Заполните капельную воронку водой. и позволить последнему падать по капле на карбид кальция: сразу образуется ацетилен, и при прохождении через раствор сульфата меди он освобождается от сероводорода и т. д. Позвольте газу уйти из подающей трубки в пневматический желоб до тех пор, пока выходящий газ не станет заметно пахнуть переменным током этилен. Затем соберите пробу газа в небольшую пробирку точно так же, как описано для этилена. Зажигают образец горелкой, расположенной, как и прежде, на безопасном расстоянии от прибора. Если воздух в аппарате еще не был полностью вытеснен, образец газа взорвется с резким звуком: если, однако, ацетилен не содержит воздуха, он будет тихо гореть с очень дымным пламенем, оставляющим углерод в трубке. в отличие от ясного пламени горящего этилена ». [19]
Склеивание
С точки зрения теория валентной связи, в каждом атоме углерода 2s орбитальный гибридизирует с одной 2p-орбиталью, образуя sp-гибрид. Две другие 2p-орбитали остаются негибридизированными. Два конца двухспирального гибрида орбитальное перекрытие сформировать сильный σ валентная связь между атомами углерода, в то время как на каждом из двух других концов атомы водорода присоединяются также посредством σ-связей. Две неизменные 2p-орбитали образуют пару более слабых π связи.[20]
Поскольку ацетилен линейный симметричная молекула, он обладает D∞h точечная группа.[21]
Физические свойства
Изменения состояния
При атмосферном давлении ацетилен не может существовать в виде жидкости и не имеет температуры плавления. В тройная точка на фазовая диаграмма соответствует температуре плавления (-80,8 ° C) при минимальном давлении, при котором может существовать жидкий ацетилен (1,27 атм). При температурах ниже тройной точки твердый ацетилен может сразу перейти в пар (газ) сублимация. Температура сублимации при атмосферном давлении -84,0 ° C.[22]
Другой
При комнатной температуре растворимость ацетилена в ацетон составляет 27,9 г на кг. На такое же количество диметилформамид (ДМФА), растворимость 51 г. При давлении 20,26 бар растворимость увеличивается до 689,0 и 628,0 г для ацетона и ДМФ соответственно. Эти растворители используются в газовых баллонах под давлением.[23]
Приложения
Сварка
Примерно 20% ацетилена поставляется промышленность промышленных газов за окси ацетилен газовая сварка и резка из-за высокой температуры пламени. При сжигании ацетилена с кислородом образуется пламя температурой более 3600 К (3330 ° C; 6020 ° F), выделяя 11,8кДж /грамм. Кислородно-ацетилен — это самый горячий из обычных топливных газов.[24] Ацетилен является третьим по популярности естественным химическим пламенем после дицианоацетилен 5,260 К (4,990 ° C; 9,010 ° F) и циан при 4798 К (4525 ° C; 8177 ° F). Кислородно-ацетиленовая сварка был популярным процессом сварки в предыдущие десятилетия. Развитие и преимущества процессы дуговой сварки сделали кислородно-топливную сварку практически исчезнувшей для многих приложений. Значительно снизилось использование ацетилена для сварки. С другой стороны, кислородно-ацетиленовая сварка оборудование довольно универсален — не только потому, что горелка предпочтительна для некоторых видов сварки чугуна или стали (как в некоторых художественных приложениях), но также потому, что она легко поддается пайке, сварке припоем, нагреву металла (для отжига или отпуска, гибки или формование), ослабление корродированных гаек и болтов и другие применения. Bell Canada техники по ремонту кабелей по-прежнему используют переносные комплекты горелок, работающих на ацетиленовом топливе, как пайка инструмент для заделки стыков свинцовой гильзы в люки и в некоторых надземных местах. Кислородно-ацетиленовую сварку также можно использовать в областях, где нет доступа к электричеству. Кислородно-ацетиленовая резка используется во многих цехах металлообработки. Для использования при сварке и резке рабочее давление должно контролироваться с помощью регулятора, поскольку выше 15 фунтов на кв. Дюйм (100 кПа) при воздействии ударной волны (вызванной, например, воспоминание ), ацетилен разлагается взрывно в водород и углерод.[25]
Ацетиленовый топливный бак / горелка, как на острове Бали
Портативное освещение
Карбид кальция был использован для производства ацетилена, используемого в лампах для портативных или удаленных приложений. Он использовался для горняков и спелеологов до широкого использования лампы накаливания; или много лет спустя светодиодное освещение малой мощности / высокой яркости; и до сих пор используется горнодобывающей промышленностью в некоторых странах, где отсутствуют законы о безопасности труда. Карбидные лампы также широко использовались в качестве фар в ранних автомобилях и в качестве источника света для маяков.[26]
Пластмассы и производные акриловой кислоты
За исключением Китая, использование ацетилена в качестве химического сырья снизилось на 70% с 1965 по 2007 год из-за стоимости и экологических соображений. полугидрированный к этилен, обеспечивая сырьем для различных полиэтилен пластмассы. Еще одним важным применением ацетилена, особенно в Китае, является его преобразование в акриловая кислота производные.[6] Эти производные образуют такие продукты, как акриловые волокна, очки, краски, смолы, и полимеры.[27]
Нишевые приложения
В 1881 году русский химик Михаил Кучеров[28] описал гидратация ацетилена в ацетальдегид с использованием катализаторов, таких как бромид ртути (II). До появления Wacker процесс, эта реакция была проведена в промышленных масштабах.[29]
В полимеризация ацетилена с Катализаторы Циглера – Натта производит полиацетилен фильмы. Полиацетилен, цепь центров CH с чередующимися одинарными и двойными связями, был одним из первых обнаруженных органические полупроводники. Его реакция с йод производит материал с высокой электропроводностью. Хотя такие материалы бесполезны, эти открытия привели к развитию органические полупроводники, как признано Нобелевская премия по химии в 2000 г. Алан Дж. Хигер, Алан Джи МакДиармид, и Хидеки Сиракава.[6]
В начале 20 века ацетилен широко использовался для освещения, в том числе уличного освещения в некоторых городах.[30] Самые ранние подержанные автомобили карбидные лампы до принятия электрических фар.[31]
В 1920-х годах чистый ацетилен экспериментально использовался в качестве ингаляционный анестетик.[32]
Ацетилен иногда используется для науглероживание (то есть закалка) стали, когда объект слишком велик, чтобы поместиться в печи.[33]
Ацетилен используется для улетучивания углерода в радиоуглеродное датирование. Углеродистый материал в археологическом образце обработан литий металл в небольшой специализированной исследовательской печи для формирования карбид лития (также известный как ацетилид лития). Затем карбид может реагировать с водой, как обычно, с образованием газообразного ацетилена, который подается в масс-спектрометр для измерения изотопного отношения углерода-14 к углероду-12.[34]
Естественное явление
Энергетическое богатство тройной связи C≡C и довольно высокая растворимость ацетилена в воде делают его подходящим субстратом для бактерий при условии наличия соответствующего источника.[нужна цитата ] Идентифицирован ряд бактерий, живущих на ацетилене. В фермент ацетиленгидратаза катализирует гидратацию ацетилена с образованием ацетальдегид:[35]
- C2ЧАС2 + H2O → CH3CHO
Ацетилен — умеренно распространенное химическое вещество во Вселенной, часто связанное с атмосферой газовые гиганты.[36] Одно любопытное открытие ацетилена происходит Энцелад, луна Сатурн. Считается, что природный ацетилен образуется из каталитический разложение длинноцепочечных углеводородов при температурах 1700 К (1430 ° C; 2600 ° F) и выше. Поскольку такие температуры крайне маловероятны для такого маленького удаленного тела, это открытие потенциально наводит на мысль о каталитических реакциях на этой луне, что делает его многообещающим местом для поиска пребиотической химии.[37][38]
Реакции
Винилирование: гидратация, гидрогалогенирование и родственные реакции
В винирование В реакциях H-X соединения присоединяются по тройной связи. К ацетилену добавляют спирты и фенолы, чтобы получить виниловые эфиры. Тиолы дают винилтиоэфиры. По аналогии, винилпирролидон и винилкарбазол производятся промышленным способом путем винилирования 2-пирролидон и карбазол.[23][6]
Гидратация ацетилена представляет собой реакцию винилирования, но образующийся виниловый спирт изомеризуется до ацетальдегид. Реакция катализируется солями ртути. Эта реакция когда-то была доминирующей технологией производства ацетальдегида, но ее заменили Wacker процесс, который дает ацетальдегид путем окисления этилен, более дешевое сырье. Аналогичная ситуация и с превращением ацетилена в ценный винилхлорид к гидрохлорирование против оксихлорирование этилена.
Добавка к формальдегиду
Ацетилен присоединяется к кетонам и альдегидам в присутствии основных катализаторов. С карбонильные группы давать α -этинил спирты в этинилирование реакции:[6] Формальдегид дает последовательно пропаргиловый спирт и бутиндиол.1,4-бутиндиол производится промышленным способом таким образом из формальдегид и ацетилен.[6]
Карбонилирование
Уолтер Реппе обнаружил, что в присутствии катализаторы, ацетилен реагирует с образованием широкого спектра промышленно значимых химических веществ.[6][39][40]
С монооксид углерода, ацетилен реагирует с образованием акриловая кислота, или сложные эфиры акриловой кислоты, которые можно использовать для производства акриловое стекло:[27]
Металлоорганическая химия
Ацетилен и его производные (2-бутин, дифенилацетилен и др.) Образуют комплексы с переходными металлами. Его связывание с металлом несколько похоже на связывание этиленовых комплексов. Эти комплексы являются промежуточными продуктами многих каталитических реакций, таких как тримеризация алкинов в бензол, тетрамеризация в циклооктатетраен,[6] и карбонилирование до гидрохинон:[39]
- Fe (CO)5 + 4 С2ЧАС2 + 2 часа2О → 2 С6ЧАС4(ОЙ)2 + FeCO3 в базовых условиях (50-80 ° С, 20-25 атм).
В присутствии некоторых переходных металлов алкины претерпевают метатезис алкинов.
Металл ацетилиды, виды формулы LпM-C2R также распространены. Ацетилид меди (I) и ацетилид серебра может быть сформирован в водный решения с легкостью из-за плохого равновесие растворимости.[41]
Кислотно-основные реакции
Ацетилен имеет пKа 25, ацетилен может быть депротонированный по супербаза сформировать ацетилид:[41]
- HC≡CH + RM → RH + HC≡CM
Разные металлоорганический[42] и неорганический[43] реагенты эффективны.
Безопасность и обращение
Ацетилен не особенно токсичен, но когда образуется из карбид кальция, он может содержать токсичные примеси, такие как следы фосфин и арсин, которые придают ему отчетливую чеснок -подобный запах. Он также легко воспламеняется, как и большинство легких углеводородов, поэтому его используют при сварке. Его самая необычная опасность связана с его внутренней нестабильностью, особенно когда он находится под давлением: при определенных условиях ацетилен может реагировать в экзотермический реакция типа присоединения с образованием ряда продуктов, обычно бензол и / или винилацетилен, возможно в дополнение к углерод и водород.[нужна цитата ] Следовательно, ацетилен, если он инициирован интенсивным нагревом или ударной волной, может взрывоопасно разложиться, если абсолютное давление газа превышает примерно 200 килопаскалей (29 фунтов на квадратный дюйм). Большинство регуляторов и манометров на оборудовании сообщают манометрическое давление, поэтому безопасный предел для ацетилена составляет 101 кПа.датчик, или 15 фунтов на кв. дюйм.[44][45] Поэтому он поставляется и хранится растворенным в ацетон или же диметилформамид (DMF),[45][46][47] содержится в газовый баллон с пористым наполнением (Агамасан ), что делает его безопасным для транспортировки и использования при правильном обращении. Ацетиленовые баллоны следует использовать в вертикальном положении, чтобы не удалять ацетон во время использования.[48]
Информация о безопасном хранении ацетилена в вертикальных баллонах предоставлена OSHA,[49][50] Ассоциация сжатого газа,[45] Управление по безопасности и охране здоровья в шахтах США (MSHA),[51] EIGA,[48] и другие агентства.
Медь катализирует разложение ацетилена, в результате чего ацетилен не должен транспортироваться по медным трубам.[52]
Баллоны следует хранить в зоне, изолированной от окислителей, чтобы избежать обострения реакции в случае пожара / утечки.[45][50] Баллоны с ацетиленом не следует хранить в замкнутых пространствах, закрытых транспортных средствах, гаражах и зданиях, чтобы избежать непреднамеренной утечки, ведущей во взрывоопасную атмосферу.[45][50] В США Национальный электротехнический кодекс (NEC) требует учета опасных зон, в том числе тех, где ацетилен может выделяться во время аварий или утечек.[53] Рассмотрение может включать электрическую классификацию и использование перечисленных электрических компонентов Группы A в США.[53] Дополнительная информация об определении областей, требующих особого внимания, содержится в NFPA 497.[54] В Европе ATEX также требует рассмотрения опасных зон, где горючие газы могут выделяться во время аварий или утечек.[48]
Рекомендации
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 375. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
Название ацетилен сохраняется для соединения HC≡CH. Это предпочтительное имя ИЮПАК, но любая замена не допускается; однако в общей номенклатуре допускается замещение, например, фторацетилен [фторэтин (PIN)], но не алкильными группами или любой другой группой, которая расширяет углеродную цепь, или характеристическими группами, выраженными суффиксами.
- ^ Ациклические углеводороды. Правило А-3. Ненасыщенные соединения и одновалентные радикалы, Номенклатура органической химии ИЮПАК
- ^ а б c d Карманный справочник NIOSH по химической опасности. «#0008». Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Ацетилен — газовая энциклопедия Air Liquide». Air Liquide. Получено 27 сентября 2018.
- ^ Р. Х. Петруччи; У. С. Харвуд; Ф. Г. Херринг (2002). Общая химия (8-е изд.). Прентис-Холл. п. 1072.
- ^ а б c d е ж грамм час я j k Песслер, Питер; Хефнер, Вернер; Бакл, Клаус; Мейнасс, Гельмут; Мейсвинкель, Андреас; Вернике, Ханс-Юрген; Эберсберг, Гюнтер; Мюллер, Ричард; Бесслер (2008). «Химия ацетилена». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a01_097.pub3.
- ^ Ассоциация сжатого газа (1995) Паспорт безопасности материала и данные — Ацетилен В архиве 11 июля 2012 г. Wayback Machine
- ^ Уиттен К. В., Гэйли К. Д. и Дэвис Р. Э. Общая химия (4-е изд., Saunders College Publishing, 1992), стр. 328–329, 1046. ISBN 0-03-072373-6.
- ^ Эдмунд Дэви (август 1836 г.) «Уведомление о новом газообразном бикарбюре водорода», Отчет о шестом заседании Британской ассоциации содействия развитию науки…, 5 : 62–63.
- ^ Миллер, С. А. (1965). Ацетилен: его свойства, производство и использование. 1. Academic Press Inc.
- ^ Бертолет (1860) «Note sur une nouvelle série de composés organiques, le quadricarbure d’hydrogène et ses dérivés» (Обратите внимание на новую серию органических соединений, тетрауглеродный гидрид и его производные), Comptes rendus, серия 3, 50 : 805–808.
- ^ Бертло (1862) «Synthèse de l’acétylène par la combinaison directe du carbone avec l’hydrogène» (Синтез ацетилена прямым соединением углерода с водородом), Comptes rendus, серия 3, 54 : 640–644.
- ^ Ацетилен.
- ^ Хабил, Фил; Sachsse, Ганс (1954). «Herstellung von Acetylen durch unvollständige Verbrennung von Kohlenwasserstoffen mit Sauerstoff [Производство ацетилена путем неполного сгорания углеводородов с кислородом]». Chemie Ingenieur Technik. 26 (5): 245–253. Дои:10.1002 / cite.330260502.
- ^ Хабил, Фил; Бартоломея, Э. (1954). «Probleme großtechnischer Anlagen zur Erzeugung von Acetylen nach dem Sauerstoff-Verfahren [Проблемы крупных заводов по производству ацетилена кислородным методом]». Chemie Ingenieur Technik. 26 (5): 253–258. Дои:10.1002 / cite.330260503.
- ^ Ацетилен: как производятся продукты В архиве 20 января 2007 г. Wayback Machine
- ^ Волер (1862) «Bildung des Acetylens durch Kohlenstoffcalcium» (Образование актилена карбидом кальция), Annalen der Chemie und Pharmacie, 124 : 220.
- ^ Фриман, Гораций (1919). «Производство цианамида». Химические новости и журнал физических наук. 117: 232. Получено 23 декабря 2013.
- ^ МАНН, Ф. Г. и Сондерс, Б. С. (1960). Практическая органическая химия. (Четвертый выпуск.). Лонгманс: Лондон.
- ^ Органическая химия 7-е изд. Дж. Макмерри, Томсон, 2008 г.
- ^ Housecroft, C.E .; Шарп, А. Г. (2008). Неорганическая химия (3-е изд.). Прентис Холл. С. 94–95. ISBN 978-0-13-175553-6.
- ^ Справочник по химии и физике (60-е изд., CRC Press 1979–80), с. C-303 в таблице Физические константы органических соединений (указаны как этин).
- ^ а б Харреус, Альбрехт Людвиг; Backes, R .; Eichler, J.-O .; Feuerhake, R .; Jäkel, C .; Mahn, U .; Pinkos, R .; Vogelsang «2-Pyrrolidone, R. (2011). Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a22_457.pub2.
- ^ «Ацетилен». Продукция и снабжение> Топливные газы. Linde. Получено 30 ноября 2013.
- ^ Справочник ЭСАБ по кислородно-ацетиленовой сварке — Свойства ацетилена.
- ^ «Светильники маяка сквозь время, Томас Тэг | Общество маяков США». uslhs.org. Получено 24 февраля 2017.
- ^ а б Такаши Охара; Такахиса Сато; Нобору Симидзу; Гюнтер Прешер; Гельмут Швинд; Отто Вайберг; Клаус Мартен; Гельмут Грейм (2003). «Акриловая кислота и производные». Энциклопедия промышленной химии Ульмана: pg. 7. Дои:10.1002 / 14356007.a01_161.pub2. ISBN 3527306730.
- ^ Кучеров, М. (1881). «Ueber eine neue Methode direkter Addition von Wasser (Hydratation) an die Kohlenwasserstoffe der Acetylenreihe». Berichte der Deutschen Chemischen Gesellschaft. 14: 1540–1542. Дои:10.1002 / cber.188101401320.
- ^ Пономарев Дмитрий Александрович; Шевченко Сергей Михайлович (2007). «Гидратация ацетилена: 125 лет» (PDF). J. Chem. Educ. 84 (10): 1725. Дои:10.1021 / ed084p1725.
- ^ 100 важнейших химических соединений: справочное руководство.
- ^ Грейнджер, Д. (2001). По раннему свету автомобилей: Краткая история фары: фары 1900-х годов имели красные и зеленые линзы левого и правого борта. Национальная почта. [Издание Торонто] DT7.
- ^ Уильям Стэнли Сайкс (1930). «Ацетилен в медицине». Британская энциклопедия. 1 (14-е изд.). п. 119.
- ^ «Ацетилен». Продукты и услуги. BOC. Архивировано из оригинал 17 мая 2006 г.
- ^ Гейх, Мебус (1990). «Проблемы радиоуглеродного датирования с использованием ацетилена в качестве счетного газа». Радиоуглерод. 32 (3): 321–324. Дои:10.2458 / azu_js_rc.32.1278. Получено 26 декабря 2013.
- ^ десять граней, Феликс (2014). «Глава 2. Жизнь на ацетилене. Первозданный источник энергии». В Питере М. Х. Кронеке и Марте Э. Соса Торрес (ред.). Металлическая биогеохимия газообразных соединений окружающей среды. Ионы металлов в науках о жизни. 14. Springer. С. 15–35. Дои:10.1007/978-94-017-9269-1_2.
- ^ «Предшественник белков и ДНК, обнаруженных в звездном диске» (Пресс-релиз). Обсерватория В. М. Кека. 20 декабря 2005 г. Архивировано с оригинал 23 февраля 2007 г.
- ^ Эмили Лакдавалла (17 марта 2006 г.). «LPSC: среда днем: Кассини на Энцеладе». Планетарное общество. Архивировано из оригинал 20 февраля 2012 г.
- ^ Джон Спенсер; Дэвид Гринспун (25 января 2007 г.). «Планетарная наука: Внутри Энцелада». Природа. 445 (7126): 376–377. Дои:10.1038 / 445376b. PMID 17251967. S2CID 4427890.
- ^ а б Реппе, Уолтер; Кутепов, N; Магин, А (1969). «Циклизация ацетиленовых соединений». Angewandte Chemie International Edition на английском языке. 8 (10): 727–733. Дои:10.1002 / anie.196907271.
- ^ Тротуш, Иоан-Теодор; Циммерманн, Тобиас; Шют, Ферди (14 ноября 2013 г.). «Каталитические реакции ацетилена: новый взгляд на сырье для химической промышленности». Химические обзоры. 114 (3): 1761–1782. Дои:10.1021 / cr400357r. PMID 24228942.
- ^ а б Viehe, Хайнц Гюнтер (1969). Химия ацетиленов (1-е изд.). Нью-Йорк: Марсель Деккер, инк. С. 170–179 и 225–241. ISBN 978-0824716752.
- ^ Midland, M. M .; McLoughlin, J. I .; Верли, Ральф Т. (младший) (1990). «Получение и использование ацетилида лития: 1-метил-2-этинил-эндо-3,3-диметил-2-норборнанол ». Органический синтез. 68: 14. Дои:10.15227 / orgsyn.068.0014.
- ^ Коффман, Дональд Д. (1940). «Диметилэтинилкарбинол». Органический синтез. 40: 20. Дои:10.15227 / orgsyn.020.0040.
- ^ «Спецификация ацетилена». ООО «КФК СтарТек». Получено 2 мая 2012.
- ^ а б c d е «law.resource.org CGA g-1 2009 (включено посредством ссылки)» (PDF). Получено 30 ноября 2016.
- ^ Дауни, Н. А. (1997). Промышленные газы. Лондон; Нью-Йорк: Blackie Academic & Professional. ISBN 978-0-7514-0352-7.
- ^ Корзун, Миколай (1986). 1000 słów o materiałach wybuchowych i wybuchu. Warszawa: Wydawnictwo Ministerstwa Obrony Narodowej. ISBN 83-11-07044-Х. OCLC 69535236.
- ^ а б c «Кодекс норм EIGA: ацетилен» (PDF). Архивировано из оригинал (PDF) 1 декабря 2016 г.. Получено 30 ноября 2016.
- ^ «OSHA 29 CFR 1910.102 Ацетилен». Получено 30 ноября 2016.
- ^ а б c «OSHA 29 CFR 1926.350 Газовая сварка и резка». Получено 30 ноября 2016.
- ^ Особые опасности ацетилена В архиве 24 марта 2016 г. Wayback Machine ДЕПАРТАМЕНТ ТРУДА США Управление по безопасности и охране здоровья в шахтах — MSHA.
- ^ Daniel_Sarachick (16 октября 2003 г.). «АЦЕТИЛЕНОВАЯ БЕЗОПАСНОСТЬ» (PDF). Управление гигиены окружающей среды и безопасности (EHS). Получено 27 сентября 2018.
- ^ а б «Бесплатный доступ NFPA к изданию NFPA 70 (NEC) 2017 г.». Получено 30 ноября 2016.
- ^ «Свободный доступ NFPA к NFPA 497 — Рекомендуемая практика для классификации легковоспламеняющихся жидкостей, газов или паров и опасных (классифицированных) мест для электрических установок в областях химических процессов». Получено 30 ноября 2016.
внешняя ссылка
- Завод по производству ацетилена и подробный процесс
- Ацетилен в химии оживает!
- Ацетилен, принципы его получения и использования в Проект Гутенберг
- Фильм, объясняющий образование ацетилена из карбида кальция и пределы взрываемости, создающие опасность пожара.
- Карбид кальция и ацетилен в Периодическая таблица видео (Ноттингемский университет)
- CDC — Карманный справочник NIOSH по химической опасности — ацетилен
| Ацетилен | |
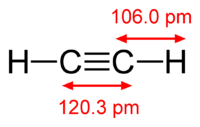 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Этин |
| Традиционные названия | Ацетилен |
| Химическая формула | C2H2 |
| Физические свойства | |
| Молярная масса | 26,038[1] г/моль |
| Плотность | 0,001173 [1] г/см³ |
| Термические свойства | |
| Температура плавления | -80, 6 °C |
| Температура кипения | −83,8 °C |
| Энтальпия образования (ст. усл.) | 226,88 кДж/моль |
| Химические свойства | |
| pKa | 25 |
| Структура | |
| Гибридизация | sp |
| Классификация | |
| Рег. номер CAS | 74-86-2 |
| SMILES | C#C |
| Номер ООН | 1001 |
Ацетиле́н (по ИЮПАК — этин) — ненасыщенный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 История
- 4 Способ производства
- 5 Применение
- 6 Безопасность
- 7 Примечания
- 8 Ссылки
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. C2H2 обнаружен на Уране и Нептуне.
Химические свойства
Ацетилено-кислородное пламя(температура «ядра» 2621 °C)
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
2СН4 = С2Н2↑ +3Н2↑
Применение
Ацетиленовая лампа
Ацетилен используют:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях(вместе с аммиаком)[2]
Безопасность
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном. При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Примечания
- ↑ 1 2 ГОСТ 5457-75. Ацетилен растворённый и газообразный технический. Технические условия
- ↑ В России разработали ракетный двигатель на аммиаке — Известия
Ссылки
- Ацетилен // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
| |
|
|---|---|
| Алканы | Метан • Этан • Пропан • Бутан • Пентан • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Гексадекан • Эйкозан … |
| Алкены | Этилен • Пропен • Бутен • Пентен • Гексен • Гептен • Октен … |
| Алкины | Ацетилен • Пропин • Бутин |
| Диены | Пропадиен • Бутадиен • Изопрен |
| Другие ненасыщеные | Винилацетилен • Диацетилен |
| Циклоалканы | Циклопропан • Циклобутан • Циклопентан • Циклогексан • Декалин • Индан |
| Ароматические | Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Индан • Циклобутадиен • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан |
| Полициклические | Нафталин • Антрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен |
Ацетилен, получение, свойства, химические реакции.
Ацетилен, C2H2 – органическое вещество класса алкинов, непредельный углеводород.
Ацетилен, формула, газ, характеристики
Физические свойства ацетилена
Химические свойства ацетилена
Получение ацетилена в промышленности и лаборатории
Химические реакции – уравнения получения ацетилена
Применение и использование ацетилена
Взрывоопасность ацетилена и безопасность при обращении с ним
Ацетилен, формула, газ, характеристики:
Ацетилен (также – этин) – органическое вещество класса алкинов, непредельный углеводород, состоящий из двух атомов углерода и двух атомов водорода.
Химическая формула ацетилена C2H2. Структурная формула ацетилена СH≡CH. Изомеров не имеет.
Строение молекулы ацетилена:
Ацетилен имеет тройную связь между атомами углерода.
Ацетилен – бесцветный газ, без вкуса и запаха. Однако технический ацетилен содержит примеси – фосфористый водород, сероводород и пр., которые придают ему резкий запах.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,9.
Очень горючий газ. Пожаро- и взрывоопасен.
Ацетилен относится к числу немногих соединений, горение и взрыв которых возможны в отсутствии кислорода или других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном. В них ацетилен хранится в виде раствора с ацетоном.
Малорастворим в воде. Очень хорошо растворяется в ацетоне. Хорошо растворяется в других органических веществах (бензине, бензоле и пр.)
Ацетилен обладает незначительным токсическим действием.
Физические свойства ацетилена:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 1,0896 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 1,173 |
| Температура плавления, °C | -80,8 |
| Температура кипения, °C | -80,55 |
| Тройная точка, °C | 335 |
| Температура самовоспламенения, °C | 335 |
| Давление самовоспламенения, МПа | 0,14-0,16 |
| Критическая температура*, °C | 35,94 |
| Критическое давление, МПа | 6,26 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,1 до 100 |
| Удельная теплота сгорания, МДж/кг | 56,9 |
| Температура пламени, °C | 3150-3200 |
| Молярная масса, г/моль | 26,038 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства ацетилена:
Химические свойства ацетилена аналогичны свойствам других представителей ряда алкинов. Поэтому для него характерны следующие химические реакции:
- 1. галогенирование ацетилена:
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен);
CHBr=CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-тетрабромэтан).
Реакция протекает стадийно с образованием производных алканов.
В ходе данной реакции ацетилен обесцвечивает бромную воду.
- 2. гидрогалогенирование ацетилена:
СH≡CH + HBr → CH2=CHBr (бромэтен).
- 3. гидратация ацетилена (реакция Михаила Григорьевича Кучерова, 1881 г.):
CH≡CH + H2O → [CH2=CH-OH] (енол) → CH3-CH=O (уксусный альдегид ) (kat = HgSO4, Hg(NO3)2).
- 4. тримеризация ацетилена (реакция Николая Дмитриевича Зелинского, 1927 г.):
3СH≡CH → C6H6 (бензол) (kat = активированный уголь, to = 450-500 оС).
Реакция тримеризации ацетилена является частным случаем реакции полимеризации ацетилена и происходит при пропускании ацетилена над активированным углем при температуре 450-500 оС.
- 5. димеризация ацетилена:
СH≡CH + СH≡CH → CH2=CH-С≡CH (винилацетилен) (kat = водный раствор CuCl и NH4Cl).
Реакция димеризации ацетилена является частным случаем реакции полимеризации ацетилена.
- 6. горение ацетилена:
2СH≡CH + 5О2 → 4CО2 + 2H2О.
Ацетилен горит белым ярким пламенем.
- 7. окисление ацетилена.
Протекание реакции и её продукты определяются средой, в которой она протекает.
- 8. восстановления ацетилена:
СH≡CH + Н2 → C2H4 (этилен) (kat = Ni, Pd или Pt, повышенная to);
СH≡CH + 2Н2 → C2H6 (этан) (kat = Ni, Pd или Pt, повышенная to).
Получение ацетилена в промышленности и лаборатории. Химические реакции – уравнения получения ацетилена:
Ацетилен в лабораторных условиях получается в результате следующих химических реакций:
- 1. действия воды на карбид кальция:
CаС2 + H2О → Cа(ОH)2 + C2H2.
- 2. дегидрирования метана:
2CH4 → C2H2 + 3H2 (при to > 1500 оС).
- 3. дегидрирования этилена:
CH2=CH2→ СH≡CH +H2 (kat = Pt, Ni, Al2O3, Cr2O3, to = 400-600 °C).
Ацетилен в промышленности получают следующими способами и методами:
- 4. карбидным методом:
Сначала получают известь из карбоната кальция.
CаСО3 → CаО + CO2. (to = 900-1200 оС).
Затем получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при температуре 2500-3000 °С.
CаО + 3С → CаС2 + CO. (to = 2500-3000 оС).
Далее карбид кальция обрабатывают водой по известной реакции.
CаС2 + H2О → Cа(ОH)2 + C2H2.
В итоге получается ацетилен высокой чистоты – 99,9 %.
- 5. высокотемпературным крекингом метана:
Высокотемпературный крекинг метана осуществляется по известной реакции дегидирования метана в электродуговых печах при температуре 2000-3000 °С и напряжении между электродами 1000 В. Выход ацетилена составляет 50 %.
- 6. различными способами пиролиза метана:
Разновидностью высокотемпературного крекинга метана являются регенеративный пиролиз (Вульф-процесс), окислительный пиролиз (Заксе-процесс или BASF-процесс), гомогенный пиролиз, пиролиз в среде низкотемпературной плазмы.
Так, в ходе регенеративного пиролиза сначала сжигают метан и разогревают насадку печи до 1350-1400 °С. Затем через разогретую насадку на доли секунды пропускают метан, в результате образуется ацетилен.
В ходе окислительного пиролиза метан смешивают с кислородом и сжигают. Образующееся тепло служит для нагрева остатка метана до 1600 °С, который дегидрирует в ацетилен. Выход ацетилена составляет 30-32 %.
В ходе гомогенного пиролиза метан и кислород сжигают в печи при температуре 2000 °С. Затем предварительно нагретый до 600 °С остаток метана пропускают через печь, в результате образуется ацетилен.
При пиролизе в среде низкотемпературной плазмы метан нагревают струей ионизированного газа (аргона или водорода).
Применение и использование ацетилена:
– как сырье в химической промышленности для производства уксусной кислоты, этилового спирта, растворителей, пластических масс, синтетических каучуков, ароматических углеводородов,
– для газовой сварки и резки металлов,
– для получения технического углерода,
– как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды.
Взрывоопасность ацетилена и безопасность при обращении с ним:
Ацетилен обладает взрывоопасными свойствами.
Поэтому обращение с ацетиленом требует строгого соблюдения правил техники безопасности.
Ацетилен горит и взрывается даже в отсутствии кислорода и других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций.
Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Взрываемость ацетилена зависит от множества факторов: давления, температуры, чистоты ацетилена, содержания в нем влаги, наличия катализаторов и пр. веществ и ряда других причин.
Температура самовоспламенения ацетилена при нормальном – атмосферном давлении колеблется в пределах 500-600 °C. При повышении давления существенно уменьшается температура самовоспламенения ацетилена. Так, при давлении 2 кгс/см2 (0,2 МПа, 1,935682 атм.) температура самовоспламенения ацетилена равна 630 °C. А при давлении 22 кгс/см2 (2,2 МПа, 21,292502 атм.) температура самовоспламенения ацетилена равна 350 °С.
Присутствие в ацетилене частиц различных веществ увеличивают поверхность его контакта и тем самым снижает температуру самовоспламенения при атмосферном давлении. Например, активированный уголь снижает температуру самовоспламенения ацетилена до 400 °С, гидрат оксида железа (ржавчина) – до 280-300 °С, железная стружка – до 520 °С, латунная стружка – до 500-520 °С, карбид кальция – до 500 °С, оксид алюминия – до 490 °С, медная стружка – 460 °С, оксид железа – 280 °С, оксид меди – до 250 °С.
Взрывоопасность ацетилена уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При определенных условиях ацетилен реагирует с медью, серебром и ртутью образуя взрывоопасные соединения. Поэтому при изготовлении ацетиленового оборудования (например, вентилей баллонов) запрещается применять сплавы, содержащие более 70 % Cu.
Для хранения и перевозки ацетилена используются специальные стальные баллоны белого цвета (с красной надписью «А»), заполненные инертным пористым материалом (например, древесным углём). При этом ацетилен хранится и перевозится в указанных баллонах в виде раствора ацетилена в ацетоне под давлением 1,5-2,5 МПа.
Примечание: © Фото //www.pexels.com, //pixabay.com
как получить ацетилен реакция ацетилен этен 1 2 вещество кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение ацетилена
напишите уравнение реакций ацетилен
Коэффициент востребованности
23 698
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
- Ацетилен
- химическое соединение углерода и водорода. Ацетилен легче воздуха, 1 м3 при 20°С и 760 мм рт. ст. имеет массу 1,091 кг/м3. Плотность по отношению к воздуху 0,9. Критическая температура 35,9°С и критическое давление 61,6 кгс/см2. При сгорании с кислородом он дает пламя с наиболее высокой температурой, которая достигает 3200°С, что объясняется его эндотермичностью (другие углеводороды экзотермичны, т. е. при распаде поглощают тепло). Химическая формула — C2H2, структурная формула Н-С=С-Н.
Содержание
- История получения
- Получение
- Применение
- Горение
- Хранение и транспортировка
- Физические свойства
- Коэффициенты перевода объема и массы С2Н2 при Т=15°С и Р=0,1 МПа
- Коэффициенты перевода объема и массы С2Н2 при Т=0°С и Р=0,1 МПа
- Газ в баллоне
При нормальном давлении и температуре от -82,4°С (190,6 К) до -84,0°С (189 К) переходит в жидкое состояние, а при температуре -85°С (188 К) затвердевает, образуя кристаллы плотностью 0,76 кг/м3. Жидкий и твердый ацетилен легко взрывается от трения, механического или гидравлического удара и действия детонатора. Технический ацетилен при нормальных давлении и температуре представляет собой бесцветный газ с резким специфическим чесночным запахом из-за содержащихся в нем примесей в виде сернистого водорода, аммиака, фосфористого водорода и др.
История получения ацетилена
В 1836 г. в Бристоле на заседании Британской ассоциации Эдмунд Дэви (Edmund Davy), профессор химии Дублинского Королевского общества и двоюродный брат Гемфри Дэви (Humphry Davy), сообщил:
… При попытке получить калий, сильно нагревая смесь прокаленного винного камня с древесным углем в большом железном сосуде, я получил черное вещество, которое легко разлагалось водой и образовывало газ, оказавшийся новым соединением углерода и водорода. Этот газ горит на воздухе ярким пламенем, более густым и светящимся даже сильнее, чем пламя маслородного газа (этилена). Если подача воздуха ограничена, горение сопровождается обильным отложением сажи. В контакте с хлором газ мгновенно взрывается, причем взрыв сопровождается большим красным пламенем и значительными отложениями сажи… Дистиллированная вода поглощает около одного объема нового газа, однако при нагревании раствора газ выделяется, по-видимому, не изменяясь… Для полного сгорания нового газа необходимо 2,5 объема кислорода. При этом образуются два объема углекислого газа и вода, которые являются единственными продуктами горения… Газ содержит столько же углерода, что и маслородный газ, но вдвое меньше водорода… Он удивительно подойдет для целей искусственного освещения, если только его удастся дешево получать.
Дэви получил карбид калия К2С2 и обработал его водой.
В статье о получении карбида кальция мы писали о том, что его «двууглеродистый водород» впервые был назван ацетиленом французским химиком Пьером Эженом Марселеном Бертло (Marcellin Berthelot) в 1860 г. Только через 60 лет после открытия Дэви предсказанное им использование ацетилена для освещения явилось первым толчком для его промышленного получения.
Получение ацетилена
Получение ацетилена производится двумя основными способами:
- в результате реакции карбида кальция и воды
- из метана путем сжигания в смеси с кислородом в специальных реакторах при температуре 1300-1500°C
А вот какой способ сейчас более распространён можно узнать из статьи о получении ацетилена.
Применение ацетилена
Применение ацетилена при газовой сварке обусловлено тем, что у него самая большая температуры горения. Но он также нашел свое применение в химической отрасли для получения пластмасс, синтетического каучука, уксусной кислоты и растворителей. Более подробный ответ по данному вопросу можно найти в статье о применении ацетилена.
Горение ацетилена
Горение ацетилена происходит по реакции: С2Н2 + 2,5O2=2СO2 + Н2O + Q1
Для полного сгорания 1 м3 ацетилена по вышеуказанной реакции теоретически требуется 2,5 м3 кислорода или = 11,905 м3 воздуха. При этом выделяется тепло Q1 ? 312 ккал/моль. Высшая теплотворная способность 1 м3 С2Н2 при 0°C и 760 мм рт. ст., определенная в газовом калориметре, составляет QВ = 14000 ккал/м3 (58660 кДж/м3), что соответствует расчетной:
312?1,1709?1000/26,036 = 14000 ккал/м3
Низшая теплотворная способность при тех же условиях может быть принята QH = 13500 ккал/м3 (55890 кДж/м3).
Практически для горения в горелках при восстановительном пламени в горелку подается не 2,5 м3 кислорода на 1 м3 ацетилена, а всего лишь от 1 до 1,2 м3, что примерно соответствует неполному сгоранию по реакции:
С2H2 + О2 = 2СО + H2 + Q2
где Q2 ? 60 ккал/моль или 2300 ккал/кгС2H2. Остальные 1,5-1,3 м3 кислорода поступают в пламя из окружающего воздуха, в результате чего в наружной оболочке пламени протекает реакция:
2СО + H2 + 1,5О2 = 2СO2 + H2O + Q3
Реакция неполного горения ацетилена протекает на внешней оболочке светящегося внутреннего конуса пламени, причем под влиянием высокой температуры на внутренней поверхности конуса происходит распад С2Н2 на его составляющие по реакции:
С2H2 = 2С + H2 + Q4
где Q4?54 ккал/моль или 2070 ккал/кг С2H2.
Таким образом, общая полезная теплопроизводительность пламени применительно к сварочным процессам представляет собой сумму тепла, выделяемого при распаде С2Н2, и тепла, выделяемого при неполном сгорании, что составляет Q4 + Q2 = 2070 + 2300 = 4370 ккал/кг или 4370?1,1709 ? 5120 ккал/м3.
При содержании С2Н2 в смеси около 45% (т. е. при отношении кислорода к ацетилену, примерно равном 1,25) достигается максимальная температура горения ацетилена, которая составляет 3200°С.
Следовательно, температура пламени изменяется в зависимости от состава смеси.
При содержании 27% С2Н2 достигается максимальная скорость воспламенения ацетилено-кислородной смеси, которая равна 13,5 м/сек.
Следовательно, в зависимости от состава смеси также изменяется и скорость воспламенения.
Данные зависимостей скорости воспламенения и температуры пламени и от содержания в ней ацетилена представлены ниже в таблице.
| Содержание С2Н2 в смеси в объемных процентах | 12 | 15 | 20 | 25 | 27 | 30 | 32 | 35 | 40 | 45 | 50 | 55 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Максимальная температура горения ацетилена, °С | — | 2920 | 2940 | 2960 | 2970 | 2990 | 3010 | 3060 | 3140 | 3200 | 3070 | 2840 |
| Скорость воспламенения смеси, м/сек | 8,0 | 10,0 | 11,8 | 13,3 | 13,5 | 13,1 | 12,5 | 11,3 | 9,3 | 7,8 | 6,7 | — |
Необходимо понимать, что полное сгорание ацетилено-воздушной смеси достигается при наличии в ней не более 1?100/(1+11,905)=7,75% ацетилена (так называемая стехиометрическая смесь). При этом продуктами реакции являются только углекислый газ (СО2) и вода (H2О). При содержании ацетилена более 17,37% в виде сажи выделяется свободный углерод.
С увеличение процентного содержание ацетила выделение сажи также возрастает (коптящее пламя), а при 81% С2Н2 — процесс горения прекращается или не возникает.
Хранение и транспортировка ацетилена
Ацетилен выпускают по ГОСТ 5457 растворенным и газообразным. Хранят и транспортируют его в растворенном состоянии в специальных стальных баллонах по ГОСТ 949, заполненных пористой, пропитанной ацетоном массой. Ацетилен, растворенный в ацетоне не склонен к взрывчатому распаду.
Баллоны окрашены в серый цвет и надписью красными буквами «АЦЕТИЛЕН» на верхней цилиндрической части.

Максимальное давление ацетилена при заполнении баллона составляет 2,5 МПа (25 кгс/см2), при отстое и охлаждении баллона до 20°С оно снижается до 1,9 МПа (19 кгс/см2). При этом давлении в 40-литровый баллон вмещается 5-5,8 кг С2Н2 по массе (4,6-5,3 м3 газа при 20°С и 760 мм рт. ст.).
Давление ацетилена в полностью наполненном баллоне изменяется при изменении температуры следующим образом:
| Температура, °С | -5 | 0 | 5 | 10 | 15 | 20 | 30 | 40 |
|---|---|---|---|---|---|---|---|---|
| Давление, МПа | 1,3 | 1,4 | 14 | 1,7 | 1,8 | 12 | 2,4 | 3,0 |
Другие требования техники безопасности можно узнать из статьи о классе опасности и мерах безопасности при работе с ацетиленом
Физические свойства ацетилена
Физические свойства ацетилена представлены в таблицах ниже.
Коэффициенты перевода объема и массы С2Н2 при Т=15°С и Р=0,1 МПа
| Масса, кг | Объем газа, м3 |
|---|---|
| 1,109 | 1 |
| 1 | 0,909 |
Коэффициенты перевода объема и массы С2Н2 при Т=0°С и Р=0,1 МПа
| Масса, кг | Объем газа, м3 |
|---|---|
| 1,176 | 1 |
| 1 | 0,850 |
Ацетилен в баллоне
| Наименование | Объем баллона, л | Масса газа в баллоне, кг | Объем газа (м3) при Т=15°С, Р=0,1 МПа |
|---|---|---|---|
| С2Н2 | 40 | 5 | 4,545 |
Благодаря информации в таблице можно дать ответы на часто задаваемые вопросы:
- Сколько ацетилена в одном баллоне?
Ответ: в 40 л баллоне 5 кг или 4,545 м3 ацетилена - Сколько весит баллон ацетилена?
Ответ:
58,5 кг — масса пустого баллона из углеродистой стали согласно ГОСТ 949;
18-20 кг — масса пористого материала, пропитанного ацетоном;
5,0 — кг масса С2Н2 в баллоне;
Итого: 58,5 + 20,0 + 5,0= 83,5 кг вес баллона с ацетиленом. - Сколько м3 ацетилена в баллоне
Ответ: 4,545 м3
Ненасыщенный углеводород с формулой C2H2
| Имена | |
|---|---|
| Предпочтительное название IUPAC Ацетилен | |
| Систематический IUPAC имя Ethyne | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| Ссылка Beilstein | 906677 |
| ЧЭБИ |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.000.743 |
| Номер EC |
|
| Gmelin Каталожный номер | 210 |
| KEGG |
|
| PubChem CID |
|
| Номер RTECS |
|
| UNII |
|
| Номер ООН | 1001 (растворенный ). 3138 (в смеси с этиленом и пропиленом ) |
| CompTox Dashboard (EPA) |
|
InChI
|
|
SMILES
|
|
| Свойства | |
| Химическая формула | C2H2 |
| Молярная масса | 26,038 г · моль |
| Внешний вид | Бесцветный газ |
| Запах | Без запаха |
| Плотность | 1,097 г / л = 1,097 кг / м |
| Точка плавления | -80,8 ° С (-113,4 ° F; 192,3 K) Тройная точка при 1,27 атм. |
| Условия сублимации. | -84 ° C; -119 ° F; 189 K (1 атм) |
| Растворимость в воде | слаборастворимый |
| Давление пара | 44,2 атм (20 ° C) |
| Кислотность (pK a) | 25 |
| Конъюгированная кислота | Этиний |
| Магнитная восприимчивость (χ) | -12,5 × 10 см / моль |
| Структура | |
| Молекулярная форма | Линейная |
| Термохимия | |
| Стандартная молярная. энтропия (S 298 ) | 201 Дж / (моль · К) |
| Стандартная энтальпия. образования (ΔfH298 ) | +226,88 кДж / моль |
| Опасности | |
| Пиктограммы GHS | |
| Сигнальное слово GHS | Опасно |
| Предупреждения об опасности GHS | H220, H336 |
| Меры предосторожности GHS | P202, P210, P261, P271, P304, P340, P312, P377, P381, P403, P403, P233, P405, P501 |
| NFPA 704 (огненный алмаз) |  4 1 3 4 1 3 |
| самовоспламенение. температура | 300 ° C (572 ° F; 573 K) |
| NIOSH (пределы воздействия на здоровье США): | |
| PEL (Допустимо) | нет |
| REL (Рекомендуется) | C 2500 ppm (2662 мг / м) |
| IDLH (Im опосредовать опасность) | ND |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в информационном окне | |
Ацетилен(систематическое название : этин) — это химическое соединение по формуле C 2H2. Это углеводород и простейший алкин. Этот бесцветный газ (низшие углеводороды, как правило, газообразны по своей природе) широко используется в качестве топлива и химического строительного элемента. В чистом виде он нестабилен, поэтому с ним обычно обращаются как с раствором. Чистый ацетилен не имеет запаха, но коммерческие сорта обычно имеют заметный запах из-за примесей.
Как алкин, ацетилен ненасыщен, потому что два его атома углерода связаны вместе в тройной связи. Тройная связь углерод-углерод помещает все четыре атома на одну прямую с валентным углом CCH 180 °.
Содержание
- 1 Discovery
- 2 Подготовка
- 3 Связь
- 4 Физические свойства
- 4.1 Изменения состояния
- 4.2 Другое
- 5 Области применения
- 5.1 Сварка
- 5.2 Переносное освещение
- 5.3 Пластмассы и производные акриловой кислоты
- 5.4 Нишевые применения
- 6 Естественные явления
- 7 Реакции
- 7.1 Винилирование: гидратация, гидрогалогенирование и родственные реакции
- 7.2 Добавление формальдегида
- 7.3 Карбонилирование
- 7.4 Металлоорганическая химия
- 7.5 Кислотно-основные реакции
- 8 Безопасность и обращение
- 9 Ссылки
- 10 Внешние ссылки
Discovery
Ацетилен был открыт в 1836 году Эдмундом Дэви, который определил его как «новый карбюратор водорода». Это было случайное открытие при попытке выделить металл калий. Нагревая карбонат калия с углеродом при очень высоких температурах, он получил остаток того, что сейчас известно как карбид калия (K 2C2), который реагировал с водой с выделением нового газа. Он был повторно открыт в 1860 году французским химиком Марселленом Бертло, который придумал название ацетилен. Эмпирическая формула Бертло для ацетилена (C 4H2), а также альтернативное название «quadricarbure d’hydrogène» (квадрикарбид водорода) были неверными, потому что химики в то время использовали неправильную атомную массу для углерода (6 вместо 12). Бертло смог приготовить этот газ, пропуская пары органических соединений (метанол, этанол и т. Д.) Через раскаленную трубу и собирая выходящий поток. Он также обнаружил, что ацетилен образовывался в результате искрения электричества через смешанные циан и водород газы. Позже Бертло получил ацетилен, пропуская водород между полюсами угольной дуги. Коммерчески доступный газообразный ацетилен может иметь запахи от примесей дивинилсульфида и фосфина.
Получение
С 1950-х годов ацетилен в основном производился путем частичного сжигания из метана. Это рекуперированный побочный продукт при производстве этилена путем крекинга углеводородов. В 1983 году этим методом было произведено около 400 000 тонн. Его присутствие в этилене обычно нежелательно из-за его взрывоопасности и способности отравлять катализаторы Циглера – Натта. Его селективно гидрируют в этилен, обычно с использованием катализаторов Pd-Ag.
До 1950-х годов, когда нефть вытеснила уголь в качестве основного источника из восстановленного углерода, ацетилена (и ароматической фракции из каменноугольной смолы ) были основным источником органических химикатов в химической промышленности. Он был получен путем гидролиза карбида кальция, реакции, открытой Фридрихом Вёлером в 1862 году и до сих пор знакомой студентам:
- CaC 2 + 2H 2 O → Ca (OH) 2 + C 2H2
Производство карбида кальция требует чрезвычайно высоких температур, ~ 2000 ° C, что требует использования электродуговая печь. В США этот процесс был важной частью революции в химии конца 19 века, которая стала возможной благодаря масштабному проекту гидроэлектростанции на Ниагарском водопаде.
«ИЗ КАРБИДА КАЛЬЦИЯ. Поместите небольшие комочки карбида кальция (около 15 г) в перегонной колбе на 150 мл (или в колбе Бюхнера аналогичной емкости) и поместите в горлышко колбы высокую капельную воронку, стержень которой был оттянут в тонкий момент: шток должен проходить глубоко ниже бокового ответвления колбы. Подсоедините это боковое плечо к промывочной емкости, содержащей 10% водный раствор сульфата меди: таким образом, требуется высокая капельная воронка для создания достаточного «напора» воды в воронку, чтобы пропустить ацетилен через промывочную бутыль. Затем наденьте на промывочную бутыль подающую трубку, которая точно переходит в пневматический желоб. Заполните капельную воронку водой и дайте последней стечь по капле. переходят на карбид кальция: сразу образуется ацетилен, а при прохождении через раствор сульфата меди освобождается от сероводорода и т. д. Дайте газу выйти из нагнетательной трубки в пневматическом желобе до тех пор, пока выходящий газ не станет заметно пахнуть ацетиленом. Затем соберите пробу газа в небольшую пробирку точно так же, как описано для этилена. Зажигают образец горелкой, расположенной, как и прежде, на безопасном расстоянии от прибора. Если воздух в аппарате еще не был полностью вытеснен, образец газа взорвется с резким звуком: если, однако, ацетилен не содержит воздуха, он будет гореть тихо с очень дымным пламенем, оставляющим углерод в трубке. в явном контрасте с чистым пламенем горящего этилена ».
Связь
С точки зрения теории валентных связей, в каждом атоме углерода 2s орбиталь гибридизуется с одной 2p-орбиталью, образуя sp-гибрид. Две другие 2p-орбитали остаются негибридизированными. Два конца двух sp-гибридных орбиталей перекрываются с образованием сильной σ валентная связь между атомами углерода, в то время как на каждом из двух других концов атомы водорода присоединяются также посредством σ-связей. Две неизмененные 2p-орбитали образуют пару более слабых π-связей.
Поскольку ацетилен является линейным симметричная молекула, она обладает точечной группой D ∞h.
Физические свойства
Изменения состояния
При атмосферном давлении ацетилен не может существовать как жидкий и не имеет температуры плавления. Тройная точка на фазовой диаграмме соответствует температуре плавления (-80,8 ° C) при минимальном давлении, при котором может существовать жидкий ацетилен (1,27 атм). При температурах ниже тройной точки твердый ацетилен может непосредственно превращаться в пар (газ) посредством сублимации. Точка сублимации при атмосферном давлении составляет -84,0 ° C.
Other
При комнатной температуре растворимость ацетилена в ацетоне составляет 27,9 г на кг. Для того же количества диметилформамида (ДМФ) растворимость составляет 51 г. При давлении 20,26 бар растворимость увеличивается до 689,0 и 628,0 г для ацетона и ДМФ соответственно. Эти растворители используются в баллонах со сжатым газом.
Области применения
Сварка
Примерно 20% ацетилена поставляется промышленными газами за оксиацетилен газовая сварка и резка из-за высокой температуры пламени. При сжигании ацетилена с кислородом образуется пламя с температурой более 3600 К (3330 ° C; 6020 ° F), выделяя 11,8 кДж / г. Кислородно-ацетилен — это самый горячий из обычных топливных газов. Ацетилен является третьим по горячим температурам естественным химическим пламенем после 5260 K (4990 ° C; 9010 ° F) дицианоацетилена и цианогена при 4798 K (4525 ° C; 8177 ° F).. Кислородно-ацетиленовая сварка была популярным процессом сварки в предыдущие десятилетия. Развитие и преимущества процессов дуговой сварки сделали кислородно-топливную сварку практически исчезнувшей для многих приложений. Значительно снизилось использование ацетилена для сварки. С другой стороны, оборудование для кислородно-ацетиленовой сварки довольно универсально — не только потому, что горелка предпочтительна для некоторых видов сварки чугуна или стали (как в некоторых художественных приложениях), но также потому, что она легко поддается пайке, пайке-сварке. , нагрев металла (для отжига или отпуска, гибки или формовки), ослабление корродированных гаек и болтов и другие применения. Специалисты по ремонту кабелей Bell Canada до сих пор используют портативные комплекты горелок, работающих на ацетиленовом топливе, в качестве паяльного инструмента для герметизации стыков свинцовых гильз в люках и в некоторых местах с воздуха. Кислородно-ацетиленовую сварку также можно использовать в областях, где нет доступа к электричеству. Кислородно-ацетиленовая резка используется во многих цехах металлообработки. Для использования при сварке и резке рабочее давление должно контролироваться с помощью регулятора, поскольку выше 15 фунтов на кв. Дюйм (100 кПа) при воздействии ударной волны (вызванной, например, вспышкой ) ацетилен разлагается со взрывом на водород и углерод.
Ацетиленовый топливный контейнер / горелка, которые используются на острове Бали
Портативное освещение
Карбид кальция использовался для производства ацетилена, используемого в лампах для портативных или удаленных приложений. Он использовался для горняков и спелеологов до широкого использования ламп накаливания ; или много лет спустя светодиодное освещение малой мощности / высокой яркости; и до сих пор используется горнодобывающей промышленностью в некоторых странах, где отсутствуют законы о безопасности труда. Карбидные лампы также широко использовались в качестве фар первых автомобилей и в качестве первых источников света для маяков.
Пластмассы и производные акриловой кислоты
За исключением Китая, использование ацетилена в качестве химического сырья имеет снизился на 70% с 1965 по 2007 год из-за затрат и экологических соображений. Ацетилен может быть полугидрированным до этилена, обеспечивая исходное сырье для различных полиэтиленовых пластиков. Еще одним важным применением ацетилена, особенно в Китае, является его преобразование в производные акриловой кислоты . Эти производные образуют такие продукты, как акриловые волокна, стекла, краски, смолы и полимеры.
нишевые приложения
В 1881 году русский химик Михаил Кучеров описал гидратацию ацетилена до ацетальдегида с использованием таких катализаторов, как бромид ртути (II). До появления процесса Wacker эта реакция проводилась в промышленных масштабах.
полимеризация ацетилена с катализаторами Циглера – Натта производит полиацетиленовые пленки. Полиацетилен, цепь центров CH с чередующимися одинарными и двойными связями, был одним из первых обнаруженных органических полупроводников. Его реакция с йодом дает материал с высокой электропроводностью. Хотя такие материалы бесполезны, эти открытия привели к разработке органических полупроводников, что было признано Нобелевской премией по химии в 2000 г. Аланом Дж. Хигером, Алан Дж. МакДиармид и Хидеки Сиракава.
В начале 20 века ацетилен широко использовался для освещения, в том числе уличного освещения в некоторых городах. В большинстве ранних автомобилей использовались карбидные лампы до внедрения электрических фар.
В 1920-х годах чистый ацетилен экспериментально использовался в качестве ингаляционного анестетика.
Ацетилен иногда использовался для науглероживание (то есть закалка) стали, когда объект слишком большой, чтобы поместиться в печи.
Ацетилен используется для улетучивания углерода при радиоуглеродном датировании. Углеродистый материал в археологическом образце обрабатывают металлическим литием в небольшой специализированной исследовательской печи с образованием карбида лития (также известного как ацетилид лития). Затем карбид может взаимодействовать с водой, как обычно, с образованием газообразного ацетилена для подачи в масс-спектрометр для измерения изотопного отношения углерода-14 к углероду-12.
Естественное происхождение
Энергетическое богатство тройной связи C≡C и довольно высокая растворимость ацетилена в воде делают его подходящим субстратом для бактерий при условии наличия соответствующего источника. Идентифицирован ряд бактерий, живущих на ацетилене. Фермент ацетиленгидратаза катализирует гидратацию ацетилена с образованием ацетальдегида :
- C2H2+ H 2 O → CH 3 CHO
Ацетилен — умеренно распространенное химическое вещество во Вселенной, часто связанное с атмосферой газовых гигантов. Одно любопытное открытие ацетилена было сделано на Энцеладе, спутнике Сатурна. Считается, что природный ацетилен образуется в результате каталитического разложения длинноцепочечных углеводородов при температурах 1700 К (1430 ° C; 2600 ° F) и выше. Поскольку такие температуры маловероятны для такого маленького удаленного тела, это открытие потенциально может свидетельствовать о каталитических реакциях на этой луне, что делает его многообещающим местом для поиска пребиотической химии.
Реакции
Винилирование : гидратация, гидрогалогенирование и родственные реакции
В реакциях винилированиясоединения HX присоединяются по тройной связи. К ацетилену добавляют спирты и фенолы, получая простые виниловые эфиры. Тиолы дают винилтиоэфиры. Аналогично, винилпирролидон и винилкарбазол производятся в промышленности путем винилирования 2-пирролидона и карбазола.
. Гидратация ацетилена представляет собой реакцию винилирования, но полученный виниловый спирт изомеризуется в ацетальдегид. Реакция катализируется солями ртути. Эта реакция когда-то была доминирующей технологией производства ацетальдегида, но она была вытеснена процессом Wacker, который дает ацетальдегид путем окисления этилена, более дешевого сырья. Аналогичная ситуация применима к превращению ацетилена в ценный винилхлорид посредством гидрохлорирования по сравнению с оксихлорированием этилена.
Добавление к формальдегиду
Ацетилен присоединяется к кетонам и альдегидам в присутствии основных катализаторов. С карбонильными группами для получения α -этиниловых спиртов в реакциях этинилирования : формальдегид последовательно дает пропаргиловый спирт и бутиндиол. 1,4-Бутиндиол таким образом получают промышленным способом из формальдегида и ацетилена.
Карбонилирование
Уолтер Реппе обнаружил, что в присутствии катализаторов, ацетилен реагирует с образованием широкого диапазона промышленно значимых химических веществ.
С монооксидом углерода ацетилен реагирует с образованием акриловой кислоты или сложных эфиров акриловой кислоты, которые можно использовать для производства акрилового стекла :
Металлоорганическая химия
Ацетилен и его производные (2-бутин, дифенилацетилен и т.д.) образуют комплексы с переходными металлами. Его связывание с металлом несколько похоже на связывание этиленовых комплексов. Эти комплексы являются промежуточными продуктами во многих каталитических реакциях, таких как тримеризация алкина до бензола, тетрамеризация до циклооктатетраена и карбонилирование до гидрохинона :
- Fe (CO) 5 + 4 C 2H2+ 2 H 2 O → 2 C 6H4(OH) 2 + FeCO 3 в основных условиях (50- 80 ° C, 20-25 атм).
В присутствии некоторых переходных металлов алкины претерпевают метатезис алкинов.
Металл ацетилиды, разновидности формулы L n MC 2 R, также распространены. Ацетилид меди (I) и ацетилид серебра могут быть легко образованы в водных растворах из-за плохого равновесия растворимости.
Кислотно-основные реакции
Ацетилен имеет pKa 25, ацетилен может быть депротонирован с помощью супероснования с образованием ацетилида :
- HC≡CH + RM → RH + HC≡CM
Эффективны различные металлоорганические и неорганические реагенты.
Безопасность и обращение
Ацетилен не особенно токсичен, но при образовании из карбида кальция он может содержать токсичные примеси, такие как следы фосфина и арсин, придающие ему отчетливый чесночный запах. Он также легко воспламеняется, как и большинство легких углеводородов, поэтому его используют при сварке. Его наиболее опасная опасность связана с его внутренней нестабильностью, особенно когда он находится под давлением: при определенных условиях ацетилен может реагировать в экзотермической реакции типа присоединения с образованием ряда продуктов, обычно бензола и / или винилацетилен, возможно, помимо углерода и водорода. Следовательно, ацетилен, если он инициирован интенсивным нагревом или ударной волной, может взрывоопасно разложиться, если абсолютное давление газа превышает примерно 200 килопаскалей (29 фунтов на квадратный дюйм). Большинство регуляторов и манометров на оборудовании сообщают манометрическое давление, поэтому безопасный предел для ацетилена составляет 101 кПа манометрическое или 15 фунтов на кв. Поэтому он поставляется и хранится растворенным в ацетоне или диметилформамиде (ДМФ), содержащемся в газовом баллоне с пористым наполнением (Агамассан ), что делает его безопасным для транспортировки и использования при правильном обращении. Ацетиленовые баллоны следует использовать в вертикальном положении, чтобы избежать извлечения ацетона во время использования.
Информация о безопасном хранении ацетилена в вертикальных баллонах предоставлена OSHA, Ассоциацией сжатых газов, Управлением по безопасности и охране здоровья в шахтах США (MSHA). ), EIGA и других агентств.
Медь катализирует разложение ацетилена, и поэтому ацетилен не должен транспортироваться по медным трубам.
Баллоны следует хранить отдельно от окислителей, чтобы избежать обострения реакции в случае пожара. / утечка. Баллоны с ацетиленом не следует хранить в замкнутых пространствах, закрытых транспортных средствах, гаражах и зданиях, чтобы избежать непреднамеренной утечки, ведущей во взрывоопасную атмосферу. В США Национальный электротехнический кодекс (NEC) требует рассмотрения опасных зон, включая те, где ацетилен может быть выделен во время аварий или утечек. Рассмотрение может включать электрическую классификацию и использование перечисленных электрических компонентов Группы A в США. Дополнительная информация по определению областей, требующих особого внимания, содержится в NFPA 497. В Европе ATEX также требует рассмотрения опасных зон, где горючие газы могут выделяться во время аварий или утечек.
Ссылки
Внешние ссылки
| В Викицитатнике есть цитаты, связанные с: ацетиленом |
- Завод по производству ацетилена и подробный процесс
- Ацетилен в химии оживает!
- Ацетилен, принципы его производства и использования на Проект Гутенберг
- Фильм, объясняющий образование ацетилена из карбида кальция и пределы взрываемости, образующие опасность пожара
- Карбид кальция и ацетилен в Периодическая таблица видео (Университет Ноттингема)
- CDC — Карманный справочник NIOSH по химическим опасностям — Ацетилен
Ацетилен (или по международной номенклатуре — этин) — это непредельный углеводород, принадлежащий к классу алкинов. Химическая формула ацетилена — C2H2. Атомы углерода в молекуле соединены тройной связью. Он является первым в своем гомологическом ряду. Представляет собой бесцветный газ. Очень огнеопасен.
Блок: 1/6 | Кол-во символов: 305
Источник: https://www.nastroy.net/post/atsetilen-himicheskie-svoystva-poluchenie-primenenie-meryi-predostorojnosti
Содержание
- 1 Ацетилен
- 2 Меры безопасности при работе с ацетиленом
- 3 Получение
- 3.1 В лаборатории
- 3.2 В промышленности
- 3.2.1 Получение пиролизом
- 3.2.1.1 Электрокрекинг
- 3.2.1.2 Регенеративный пиролиз
- 3.2.1.3 Окислительный пиролиз
- 3.2.1.4 Гомогенный пиролиз
- 3.2.1.5 Пиролиз в струе низкотемпературной плазмы
- 3.2.2 Карбидный метод
- 3.2.1 Получение пиролизом
- 3.3 Как синтезировался ацетилен
- 4 Химические свойства ацетилена
- 4.1 Ацетилен сегодня: способы получения
- 5 Применение ацетилена при сварке
- 6 Преимущества
- 6.1 Формула ацетилена
- 6.2 Химические и физические свойства
- 6.3 Состав
- 6.4 Технология и режимы сварки
- 6.4.1 Заключение
- 7 Взрывоопасность ацетилена и безопасность при обращении с ним:
- 8 Литература
Ацетилен
Название этого вещества связано со словом «уксус». Сегодня это единственный широко используемый в промышленности газ, горение и взрыв которого возможны в отсутствие кислорода или других окислителей. Сгорая в кислоте, он дает очень горячее пламя — до 3100°С.
Блок: 2/7 | Кол-во символов: 275
Источник: http://techgazy.ru/market/promyshlennye_i_medicinskie_gazy_svarochnye_piwevye_gazovye_smesi/szhizhennye_gazy_v_balonah_monoblokah/acetilen/acetilen/
Меры безопасности при работе с ацетиленом
- содержание ацетилена в воздухе рабочей зоны необходимо непрерывно контролировать автоматическими приборами, сигнализирующими о превышении допустимой взрывобезопасной концентрации ацетилена в воздухе, равной 0,46%;
- при работе с ацетиленовыми баллонами поблизости не должно быть открытого пламени или отопительной системы; запрещается работать с баллонами, находящимися в горизонтальном положении, с незакрепленными баллонами, с неисправными баллонами; необходимо использовать неискрящийся инструмент, освещение и электрическое оборудование только во взрывобезопасном исполнении;
- в случае обнаружения утечки ацетилена из баллона (по запаху и звуку) необходимо по возможности быстро закрыть вентиль баллона специальным неискрящимся ключом;
- при нагреве баллон с ацетиленом может взорваться с крайне разрушительными последствиями; в случае пожара необходимо по возможности удалить из опасной зоны холодные баллоны с ацетиленом, оставшиеся баллоны постоянно охлаждать водой или специальными составами до полного остывания; при загорании ацетилена, выходящего из баллона, необходимо по возможности быстро закрыть вентиль баллона специальным неискрящимся ключом и поливать баллон водой до полного остывания; при сильном возгорании пожаротушение необходимо производить с безопасного расстояния; при пожаротушении рекомендуется применять огнетушители с содержанием флегматизирующей концентрации азота 70% по объему, диоксида углерода 57% по объему, водяные струи, песок, сжатый азот, асбестовое полотно, токораспыленную пену и воду; при тушении сильного пожара используются огнезащитные костюмы, противогазы и т.п.
Блок: 2/3 | Кол-во символов: 1647
Источник: https://techgaz.zakupka.com/articles/34148-acetilen-svoystva-i-harakteristiki/
Получение
В лаборатории
В лаборатории, а также в газосварочном оборудовании, ацетилен получают действием воды на карбид кальция (Ф. Вёлер, 1862 год):
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
В промышленности
В промышленности ацетилен получают гидролизом карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом и примесями других углеводородов. Карбидный метод позволяет получать очень чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз существенно менее энергозатратен, т.к. для нагрева реактора используется сгорание того же рабочего газа во внешнем контуре, но в газовом потоке продуктов концентрация самого ацетилена низка. Выделение и концентрирование индивидуального ацетилена в таком случае представляет сложную задачу. Экономические оценки обоих методов многочисленны, но противоречивы.
Получение пиролизом
Электрокрекинг
Метан превращают в ацетилен и водород в электродуговых печах (температура 2000—3000 °С, напряжение между электродами 1000 В). Метан при этом разогревается до 1600 °С. Расход электроэнергии составляет около 13000 кВт•ч на 1 тонну ацетилена, что относительно много (примерно равно затрачиваемой энергии по карбидному методу) и потому является недостатком процесса. Выход ацетилена составляет 50 %.
Регенеративный пиролиз
Иное название — Вульф-процесс. Сначала разогревают насадку печи путём сжигания метана при 1350—1400 °С. Далее через разогретую насадку пропускают метан. Время пребывания метана в зоне реакции очень мало и составляет доли секунды. Процесс реализован в промышленности, но экономически оказался не таким перспективным, как считалось на стадии проектирования.
Окислительный пиролиз
Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600 °С. Выход ацетилена составляет 30—32 %. Метод имеет преимущества — непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется еще и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Гомогенный пиролиз
Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000 °С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600 °С. Образуется ацетилен. Метод характеризуется большей безопасностью и надёжностью работы печи.
Пиролиз в струе низкотемпературной плазмы
Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрён в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000—7000 кВт•ч) и высоких выходах ацетилена (87 % в аргоновой плазме и 73 % в водородной).
Карбидный метод
Этот способ известен с XIX века, но не потерял своего значения до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при 2500—3000 °С:
Известь получают из карбоната кальция:
Далее карбид кальция обрабатывают водой:
Получаемый ацетилен имеет высокую степень чистоты 99,9 %. Основным недостатком процесса является высокий расход электроэнергии: 10000—11000 кВт•ч на 1 тонну ацетилена.
Блок: 2/10 | Кол-во символов: 3289
Источник: https://ru.wikipedia.org/wiki/%D0%90%D1%86%D0%B5%D1%82%D0%B8%D0%BB%D0%B5%D0%BD
Как синтезировался ацетилен
Впервые ацетилен получил в 1836 Эдмунд Дэви, двоюродный брат знаменитого Гемфри Дэви. Он подействовал водой на карбид калия: К2С2 + 2Н2О=С2Н2 + 2КОН и получил новый газ, который назвал двууглеродистым водородом. Этот газ был, в основном, интересен химикам с точки зрения теории строения органических соединений. Один из создателей так называемой теории радикалов Юстус Либих назвал группу атомов (т.е. радикал) С2Н3ацетилом.
На латыни acetum – уксус; молекула уксусной кислоты (С2Н3О+О+Н, как записывали тогда ее формулу) рассматривалась как производное ацетила. Когда французский химик Марселен Бертло в 1855 сумел получить «двууглеродистый водород» сразу несколькими способами, он назвал его ацетиленом. Бертло считал ацетилен производным ацетила, от которого отняли один атом водорода: С2Н3 – Н = С2Н2. Сначала Бертло получал ацетилен, пропуская пары этилена, метилового и этилового спирта через раскаленную докрасна трубку. В 1862 он сумел синтезировать ацетилен из элементов, пропуская водород через пламя вольтовой дуги между двумя угольными электродами. Все упомянутые методы синтеза имели только теоретическое значение, и ацетилен был редким и дорогим газом, пока не был разработан дешевый способ получения карбида кальция прокаливанием смеси угля и негашеной извести: СаО + 3С = СаС2 + СО. Это произошло в конце XIX века.
Тогда ацетилен стали использовать для освещения. В пламени при высокой температуре этот газ, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени — от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому).
Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
В течение длительного времени ацетилен для технических нужд (например, на стройках) получали «гашением» карбида водой. Полученный из технического карбида кальция ацетилен имеет неприятный запах из-за примесей аммиака, сероводорода, фосфина, арсина.
Блок: 3/7 | Кол-во символов: 2387
Источник: http://techgazy.ru/market/promyshlennye_i_medicinskie_gazy_svarochnye_piwevye_gazovye_smesi/szhizhennye_gazy_v_balonah_monoblokah/acetilen/acetilen/
Химические свойства ацетилена
Исходя из тройной связи ацетилена, для него будут характерны реакции присоединения и реакции полимеризации. Атомы водорода в молекуле ацетилена могут замещаться другими атомами или группами. Поэтому можно сказать, что ацетилен проявляет кислотные свойства. Разберем химические свойства ацетилена на конкретных реакциях.
Реакции присоединения:
- Гидрирование. Осуществляется при высокой температуре и в присутствии катализатора (Ni, Pt, Pd). На палладиевом катализаторе возможно неполное гидрирование.
- Галогенирование. Может быть как частичным, так и полным. Идет легко даже без катализаторов или нагревания. На свету хлорирование идет с взрывом. При этом ацетилен полностью распадается до углерода.
- Присоединение к уксусной кислоте и этиловому спирту. Реакции идут только в присутствии катализаторов.
- Присоединение синильной кислоты.
CH≡CH + HCN → CH2=CH-CN
Реакции замещения:
- Взаимодействие ацетилена с металл-органическими соединениями.
CH≡CH + 2C2H5MgBr → 2C2H6 + BrMgC≡CMgBr
- Взаимодействие с металлическим натрием. Необходима температура 150 °C или предварительное растворение натрия в аммиаке.
2CH≡CH + 2Na → 2CH≡CNa + H2
- Взаимодействие с комплексными солями меди и серебра.
- Взаимодействие с амидом натрия.
CH≡CH + 2NaNH2 → NaC≡CNa + 2NH3
Реакции полимеризации:
- Димеризация. При этой реакции две молекулы ацетилена объединяются в одну. Необходим катализатор — соль одновалентной меди.
- Тримеризация. В этой реакции три молекулы ацетилена образуют бензол. Необходим нагрев до 70 °C, давление и катализатор.
- Тетрамеризация. В результате реакции получается восьмичленный цикл — циклооктатетраен. Для этой реакции также требуется небольшой нагрев, давление и соответствующий катализатор. Обычно это комплексные соединения двухвалентного никеля.
Это далеко не все химические свойства ацетилена.
Блок: 4/6 | Кол-во символов: 1801
Источник: https://www.nastroy.net/post/atsetilen-himicheskie-svoystva-poluchenie-primenenie-meryi-predostorojnosti
Ацетилен сегодня: способы получения
В промышленности ацетилен часто получают действием воды на карбид кальция.
Сейчас широко применяются методы получения ацетилена из природного газа – метана:
электрокрекинг (струю метана пропускают между электродами при температуре 1600°С и быстро охлаждают, чтобы предотвратить разложение ацетилена);
термоокислительный крекинг (неполное окисление), где в реакции используют теплоту частичного сгорания ацетилена.
Блок: 4/7 | Кол-во символов: 466
Источник: http://techgazy.ru/market/promyshlennye_i_medicinskie_gazy_svarochnye_piwevye_gazovye_smesi/szhizhennye_gazy_v_balonah_monoblokah/acetilen/acetilen/
Применение ацетилена при сварке
Ацетилен – основной горючий газ, используемый при газовой сварке, а также широко применяется для газовой резки (кислородной резки). Температура ацетилено-кислородного пламени может достигать 3300°C. Благодаря этому ацетилен по сравнению с более доступными горючими газами (пропан-бутаном, природным газом и др.) обеспечивает более высокое качество и производительность сварки.
Снабжение постов ацетиленом для газовой сварки и резки может осуществляться
- от баллонов с ацетиленом и
- от ацетиленового генератора.
Для хранения ацетилена обычно используются стандартные баллоны емкостью 40 л, окрашенные в белый цвет, с надписью «Ацетилен» красного цвета (ПБ 10-115-96, ГОСТ 949-73). Согласно ГОСТ 5457-75 для газопламенной обработки металлов применяется технический ацетилен растворенный марки Б и газообразный.
Таблица. Характеристики марок технического ацетилена (ГОСТ 5457-75), используемого при сварке и резке.
| Параметр | Ацетилен технический | ||
| растворенный марки Б | газообразный | ||
| первого сорта | второго сорта | ||
| Объемная доля ацетилена C2H2, %, не менее | 99,1 | 98,8 | 98,5 |
| Объемная доля воздуха и других газов, малорастворимых в воде, %, не более | 0,8 | 1,0 | 1,4 |
| Объемная доля фосфористого водорода PH3, %, не более | 0,02 | 0,05 | 0,08 |
| Объемная доля сероводорода H2S, %, не более | 0,005 | 0,05 | 0,05 |
| Массовая концентрация водяных паров при давлении 101,3 кПа (760 мм рт. ст.) и температуре 20°С, г/м3, не более | 0,5 | 0,6 | не нормируется |
| что соответствует температуре насыщения, не выше (°C) | -24 | -22 |
Баллоны заполнены пористой массой, пропитанной ацетоном. Ацетилен хорошо растворяется а ацетоне: при нормальной температуре и давлении в 1 л ацетона растворяется 23 л ацетилена (в 1 л бензина растворяется 5,7 л ацетилена, в 1 л воды – 1,15 л ацетилена). Пористая масса выполняет следующие функции:
- повышает безопасность при работе с баллоном – за счет пористой массы общий объем ацетилена разделен на отдельные ячейки; таким образом, вероятность распространения общего фронта горения и взрыва значительно уменьшается;
- позволяет повысить количество ацетилена в баллоне, ускорить процесс его растворения при заполнении баллона и выделении при отборе газа – поскольку при использовании пористой массы, пропитанной ацетоном, обеспечивается большая поверхность взаимного контакта между газом и ацетоном.
В качестве пористых масс могут применяться активированный уголь, пемза, волокнистый асбест.
Таблица. Допустимое давление газа в баллоне в зависимости от температуры (при номинальном давлении 1,9 МПа / +20°С) (ГОСТ 5457-75)
| Температура, °С | -5 | 0 | +5 | +10 | +15 | +20 | +25 | +30 | +35 | +40 | |
| Давление в
баллоне, не более |
МПа | 1,34 | 1,4 | 1,5 | 1,65 | 1,8 | 1,9 | 2,15 | 2,35 | 2,6 | 3 |
| кгс/см2 | 13,4 | 14 | 15 | 16,5 | 18 | 19 | 21,5 | 23,5 | 26 | 30 |
Таблица. Остаточное давление газа в баллоне, поступающем от потребителя (ГОСТ 5457-75)
| Температура, °С | до 0 | от 0 до +15 | от +15 до +25 | от +25 до +35 | |
| Остаточное
давление в баллоне, не менее |
МПа | 0,05 | 0,1 | 0,2 | 0,3 |
| кгс/см2 | 0,5 | 1 | 2 | 3 |
40-литровые баллоны с максимальным давлением газа 1,9 МПа при температуре 20°С обычно заполняют 5–5,8 кг ацетилена (4,6–5,3 м3 газа при температуре 20°С и давлении 760 мм рт. ст.). Масса ацетилена в баллоне определяется по разности масс баллона до и после наполнения газом. Объем ацетилена равен отношению его массы и плотности. Так, объем 5,5 кг ацетилена при температуре 20°С и давлении 760 мм рт. ст. составляет 5,5/1,09 = 5,05 м3.
Таблица. Сравнительные характеристики ацетилена, пропана и метилацетилен-алленовой фракции (МАФ)
| Параметр | ацетилен | пропан | МАФ |
| Чувствительность к удару, безопасность | нестабилен | стабилен | стабилен |
| Токсичность | незначительная | ||
| Предел взрываемости в воздухе (%) | 2,2–81 | 2,0–9,5 | 3,4–10,8 |
| Предел взрываемости в кислороде (%) | 2,3–93 | 2,4–57 | 2,5–60 |
| Температура пламени (°С) | 3087 | 2526 | 2927 * |
| Реакции с обычными металлами | избегать сплавов, содержащих более 70% меди | незначительные ограничения | избегать сплавов, содержащих более 65–67% меди |
| Склонность к обратному удару | значительная | незначительная | незначительная |
| Скорость сгорания в кислороде (м/с) | 6,10 | 3,72 | 4,70 |
| Плотность газа (кг/м3) | 1,17 (при 0°С)
1,09 (при 20°С) |
2,02 (при 0°С) | 1,70 (при 0°С) * |
| Плотность в жидком состоянии при 15,6°С (кг/м3) | – | 513 | 575 |
| Отношение расхода кислорода к горючему газу (м3/м3) при нормальном пламени | 1–1,2 | 3,50 | 2,3–2,5 |
Блок: 3/3 | Кол-во символов: 4253
Источник: https://techgaz.zakupka.com/articles/34148-acetilen-svoystva-i-harakteristiki/
Преимущества
Популярность ацетилен заслужил благодаря ряду следующих преимуществ:
- Применение газа, в сравнение с другими разновидностями, является выгодным с экономической точки зрения;
- Есть возможность получать сырье не только закупая его в баллонах и заправляя их, но и добывать при помощи соответствующих генераторов, путем добавления воды на карбид кальция;
- Горение ацетилена имеет самую большую температуру среди защитных газов.
При этом имеется ряд недостатков затрудняющих его использования во многих случаях:
- Во время работы с этим газом получается высокая загазованность помещения, так что нужно сильное проветривание;
- Много условий обеспечения безопасности для нормального хранения;
- Высокий уровень взрывоопасности;
- Из-за высокой температуры могут возникать такие виды дефектов как перегрев или пережог, особенно, при работе с тонкими металлами.
Формула ацетилена
Газ является непредельным углеводородом, который обладает тройной связью атомов углерода. Формула ацетилена – С2Н2. При этом структурная формула ацетилена выглядит следующим образом Н-С=С-Н, так как связь идет между атомами углерода.
Химические и физические свойства
В нормальных условиях газ является бесцветным. Он легче воздуха. В техническом ацетилене имеются добавки, которые придают ему резкий запах, но в чистом виде он ни чем не пахнет. Лучше всего газ растворяется в ацетоне, но в воде он мало растворим. Температура кипения достигает -83,6 градусов Цельсия.
Газ требует очень аккуратного обращения. Баллон может взорваться от обыкновенного удара при падении или при нагреве около 500 градусов Цельсия. Воспламениться струя может даже от статического электричества от пальца человеческой руки. Молярная масса ацетилена составляет 26 г/моль. Температура горения ацетилена в ядре пламени может составлять более 2600 градусов Цельсия.
Химические свойства ацетилена показывают, в какие реакции может вступать субстанция с другими веществами. В присутствии катализаторов, в частности солей ртути, газ образует уксусный альдегид. Благодаря наличию тройной связи, молекулы вещества имеют большой запас энергии. Это обеспечивает ей высокую теплоту сгорания, которая составляет 14 000 ккал/м3. Если при сгорании добавить струю кислорода, то температура пламени достигнет более 3100 градусов Цельсия. Газ может полимеризироваться в такое вещество как бензол и прочие органические соединения, к примеру, винилацетилен или полиацетилен. Полимеризация в бензол происходит при температуре в 500 градусов Цельсия и при наличии графита. Если в качестве катализатора использоваться трикарбонил никеля, то данная реакция может пройти при температуре в 65 градусов Целься. Ацетилен обладает очень сильными кислотными свойствами. Атомы водорода могут легко отщепиться в качестве протонов. В эфирном растворе металмагнийбромида данный газ вытесняет метан. В сочетании с солями одновалентной меди и серебра ацетилен образует взрывчатый нерастворимый осадок.
Состав
Горение ацетилена и прочие его практические свойства во многом зависят от состава. Даже небольшие отклонения от нормы могут привести к тому, что газ поменяет свои характеристики. Поэтому, выделяют несколько основных сортов, отличающихся друг от друга по своему составу.
Состав ацетилена газообразного технического:
- Основной газ – 98,5%;
- Воздух – 1,4%;
- Фосфорный водород – 0,08%;
- Сероводород – 0,05%.
Растворенное вещество первого сорта марки Б должно обладать следующим составом:
- Основной газ – 99,1%;
- Воздух – 0,8%;
- Фосфорный водород – 0,02%;
- Сероводород – 0,005%.
Растворенное вещество второго сорта марки Б должно обладать следующим составом:
- Основной газ – 98,8%;
- Воздух – 1%;
- Фосфорный водород – 0,05%;
- Сероводород – 0,05%.
Растворенное вещество марки А должно обладать следующим составом:
- Основной газ – 99,5%;
- Воздух – 0,5%;
- Фосфорный водород – 0,005%;
- Сероводород – 0,002%.
Технология и режимы сварки
Перед началом сварки нужно подобрать баллон с ацетиленом и понять саму его конструкцию.
Конструкция баллона с ацетиленом
Потом подбирается горелка требуемого размера от 0 до 5. Толщина этого инструмента определяет расход газа, а также ширину образуемого шва. Чтобы проверить готовность изделия к работе, ее нужно продуть ацетиленом до тех пор, чтобы почувствовать его запах.
Поджог газа осуществляется еще до добавления кислорода. После загорания можно добавить понемногу струю кислорода, пока не образуется устойчивое пламя. Выходное давление основного газа должно быть до 4 атмосфер, а дополнительного – до 2 атмосфер. Затем подбирается мощность пламени согласно толщине свариваемого металла.
Заранее очищенные заготовки предварительно прогреваются пламенем горелки до нужной температуры. После этого добавляется сварочная проволока, которая вместе с основным металлом образует сварочную ванну. Процесс сварки может проводиться как правым, так и левым способом. После окончания процедуры горение ацетилена поможет постепенному охлаждению шва с подогревом.
Заключение
Разбираясь, для чего нужен ацетилен в сварочной области, в первую очередь нужно думать о безопасности. Отличные практические качества и низкая стоимость газа не позволяют отказаться от него полностью из-за взрывоопасности. Любой специалист может оценить все преимущества работы с ним, но сложности хранения затрудняют его применение в домашних условиях.
Блок: 3/3 | Кол-во символов: 5217
Источник: https://svarkaipayka.ru/material/zashhitnyie-gazyi/svoystva-atsetilena.html
Взрывоопасность ацетилена и безопасность при обращении с ним:
Ацетилен обладает взрывоопасными свойствами.
Поэтому обращение с ацетиленом требует строгого соблюдения правил техники безопасности.
Ацетилен горит и взрывается даже в отсутствии кислорода и других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций.
Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Взрываемость ацетилена зависит от множества факторов: давления, температуры, чистоты ацетилена, содержания в нем влаги, наличия катализаторов и пр. веществ и ряда других причин.
Температура самовоспламенения ацетилена при нормальном – атмосферном давлении колеблется в пределах 500-600 °C. При повышении давления существенно уменьшается температура самовоспламенения ацетилена. Так, при давлении 2 кгс/см2 (0,2 МПа, 1,935682 атм.) температура самовоспламенения ацетилена равна 630 °C. А при давлении 22 кгс/см2 (2,2 МПа, 21,292502 атм.) температура самовоспламенения ацетилена равна 350 °С.
Присутствие в ацетилене частиц различных веществ увеличивают поверхность его контакта и тем самым снижает температуру самовоспламенения при атмосферном давлении. Например, активированный уголь снижает температуру самовоспламенения ацетилена до 400 °С, гидрат оксида железа (ржавчина) – до 280-300 °С, железная стружка – до 520 °С, латунная стружка – до 500-520 °С, карбид кальция – до 500 °С, оксид алюминия – до 490 °С, медная стружка – 460 °С, оксид железа – 280 °С, оксид меди – до 250 °С.
Взрывоопасность ацетилена уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При определенных условиях ацетилен реагирует с медью, серебром и ртутью образуя взрывоопасные соединения. Поэтому при изготовлении ацетиленового оборудования (например, вентилей баллонов) запрещается применять сплавы, содержащие более 70 % Cu.
Для хранения и перевозки ацетилена используются специальные стальные баллоны белого цвета (с красной надписью «А»), заполненные инертным пористым материалом (например, древесным углём). При этом ацетилен хранится и перевозится в указанных баллонах в виде раствора ацетилена в ацетоне под давлением 1,5-2,5 МПа.
карта сайта
как получить ацетилен реакция ацетилен этен 1 2 вещество кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение ацетилена
напишите уравнение реакций ацетилен
comments powered by HyperComments
Блок: 8/8 | Кол-во символов: 2774
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/atsetilen-poluchenie-svoystva-himicheskie-reaktsii/
Литература
- Миллер С. А. Ацетилен, его свойства, получение и применение. — Л.: Химия, 1969. — Т. 1. — 680 с.
- Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х частях. Часть 1. — М.: Ассоциация «Пожнаука», 2004. — 713 с. — ISBN 5-901283-02-3.
- Хвостов И. В. Ацетилен // Химическая энциклопедия: в 5 т. / Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 226—228. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
Блок: 9/10 | Кол-во символов: 515
Источник: https://wiki2.org/ru/%D0%90%D1%86%D0%B5%D1%82%D0%B8%D0%BB%D0%B5%D0%BD
Кол-во блоков: 17 | Общее кол-во символов: 23470
Количество использованных доноров: 8
Информация по каждому донору:
- https://ru.wikipedia.org/wiki/%D0%90%D1%86%D0%B5%D1%82%D0%B8%D0%BB%D0%B5%D0%BD: использовано 1 блоков из 10, кол-во символов 3289 (14%)
- http://ru.solverbook.com/spravochnik/ximiya/soedineniya/acetilen/: использовано 1 блоков из 6, кол-во символов 541 (2%)
- https://www.nastroy.net/post/atsetilen-himicheskie-svoystva-poluchenie-primenenie-meryi-predostorojnosti: использовано 2 блоков из 6, кол-во символов 2106 (9%)
- https://techgaz.zakupka.com/articles/34148-acetilen-svoystva-i-harakteristiki/: использовано 2 блоков из 3, кол-во символов 5900 (25%)
- https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/atsetilen-poluchenie-svoystva-himicheskie-reaktsii/: использовано 1 блоков из 8, кол-во символов 2774 (12%)
- https://wiki2.org/ru/%D0%90%D1%86%D0%B5%D1%82%D0%B8%D0%BB%D0%B5%D0%BD: использовано 1 блоков из 10, кол-во символов 515 (2%)
- http://techgazy.ru/market/promyshlennye_i_medicinskie_gazy_svarochnye_piwevye_gazovye_smesi/szhizhennye_gazy_v_balonah_monoblokah/acetilen/acetilen/: использовано 3 блоков из 7, кол-во символов 3128 (13%)
- https://svarkaipayka.ru/material/zashhitnyie-gazyi/svoystva-atsetilena.html: использовано 1 блоков из 3, кол-во символов 5217 (22%)
|
Поделитесь в соц.сетях: |
Оцените статью:
|