ГДЗ Химия 8 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А. 2019 §32 ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
Красным цветом даются ответы, а фиолетовым ― объяснения.
Задание 1
Раскройте физический смысл порядкового номера химического элемента, номера периода, номера группы.
Порядковый номер химического элемента соответствует положительному заряду атомного ядра, т. е. числу содержащихся в нём протонов. Так как атом электронейтрален, то очевидно, что порядковый номер химического элемента соответствует также числу электронов, образующих электронную оболочку атома.
Номер периода, в котором расположен химический элемент, соответствует числу энергетических уровней (электронных слоёв) в атоме.
Номер группы соответствует числу электронов на внешнем энергетическом уровне атомов элементов А-групп.То есть, данная константа очень важна, потому что выражает величину заряда ядра.
Задание 2
Как изменяются металлические и неметаллические свойства химических элементов:
а) в периодах;
В периодах с ростом порядкового номера химического элемента (слева направо) ослабевают металлические свойства и усиливаются неметаллические.
б) в группах?
В подгруппах с ростом порядкового номера химического элемента (сверху вниз) ослабевают неметаллические свойства и усиливаются металлические.
Задание 3
Охарактеризуйте химические элементы литий, бериллий и бор по плану:
|
ПЛАН |
литий |
бериллий |
бор |
| порядковый номер; | 3 | 4 | 5 |
| положение в Периодической системе (номер периода, номер группы, подгруппа); | 2 период, I группа, главная подгруппа |
2 период, II группа, главная подгруппа |
2 период, III группа, главная подгруппа |
| число протонов в ядре атома; | 3 | 4 | 5 |
| число энергетических уровней | 2 | 2 | 2 |
| общее число электронов; | 3 | 4 | 5 |
| число электронов на внешнем энергетическом уровне | 1 | 2 | 3 |
Задание 4
Определите количество электронов, которые нужно отдать или присоединить для получения завершённого внешнего энергетического уровня атомам следующих химических элементов:
кислород, Присоединить два (8-6=2)
натрий, Отдать один.
хлор, Присоединить один (8-7=1)
магний. Отдать два.
Чтобы определить число электронов, необходимое атому для завершения внешнего энергетического уровня, от восьми нужно отнять число электронов на внешнем энергетическом уровне, которое соответствует номеру группы, в которой находится химический элемент в Периодической системе Д.И.Менделеева.
Задание 5
Символы каких трёх химических элементов расположены в порядке увеличения радиусов их атомов:
а) P, Si; Al; Радиус в периоде (P, Si, Al) увеличивается.
б) С, N. О;
в) Са, Мg, Ве;
г) С, В, Аl? Радиус в периоде (С, В) и группе (В, Аl) увеличивается.
Радиус увеличивается вниз по подгруппе (за счет роста числа энергетических уровней) и справа налево по периоду (за счет уменьшения числа внешних электронов и силы их притяжения к ядру).
Задание 6
Выберите ряд чисел, которому соответствует распределение электронов по энергетическим уровням атома, металлические свойства которого выражены наиболее ярко:
а) 2, 8, 2; Магний Mg
б) 2, 8, 5; Фосфор P
в) 2, 8, 1; Натрий Na
г) 2, 8, 8, 1. Калий K
Наиболее сильно металлические свойства выражены в элемента с наименьшим числом внешних электронов и наибольшим числом энергетических уровней.
Задание 7
Дайте свою оценку строкам из стихотворения С. Щипачёва «Читая Менделеева»: Другого ничего в природе нет ни здесь, ни там, в космических глубинах: всё — от песчинок малых до планет — из элементов состоит единых.
С. Щипачёв поэтично изложил мысль о фундаментальном законе природе — периодическом законе, позволяющем объяснить и предусмотреть свойства химических элементов и образуемых ими соединений.
Страница 9 из 29
Вопросы перед параграфом
Задание №1
Какую информацию можно найти в Периодической системе?
Ответ
Из Периодической системы можно узнать:
1) Название элемента − фтор
2) Химический символ − F
3) Порядковый номер −19
4) Заряд ядра − +9
5) Число электронов в атоме − 9
6) Атомную массу − 18,9984
(стр.46)
Задание №1
Найдите закономерности в изменении атомных номеров в главной и побочной подгруппах.
Ответ
В главных подгруппах разница между атомными номерами составляет:
8, 8, 18, 18, 32 ( Атомные массы: $Li$−3; $Na$−11; $K$−19; $Rb$−37; $Cs$−55; $Fr$−87)
В побочных подгруппах разница между атомными номерами составляет:
18, 32, 32 ( Атомные массы: $Cu$−29; $Ag$−47; $Au$−79; $Rg$−111)
Проблемный вопрос
Задание №1
Есть ли границы у периодической системы?
Ответ
Чётких границ у периодической системы на данный момент времени нет, так как учёные до сих пор работают над созданием новых элементов.
Самый последний элемент, который был открыт, − это Оганессий (Og) в 2015 году. 118−ый элемент, которому сначала было присвоено временное название «унуктоний» был в дальнейшем назван в честь академика наук Юрия Цолаковича Оганесяна за его исследования трансактиновидных элементов.
Вопросы и задания
Задание №1
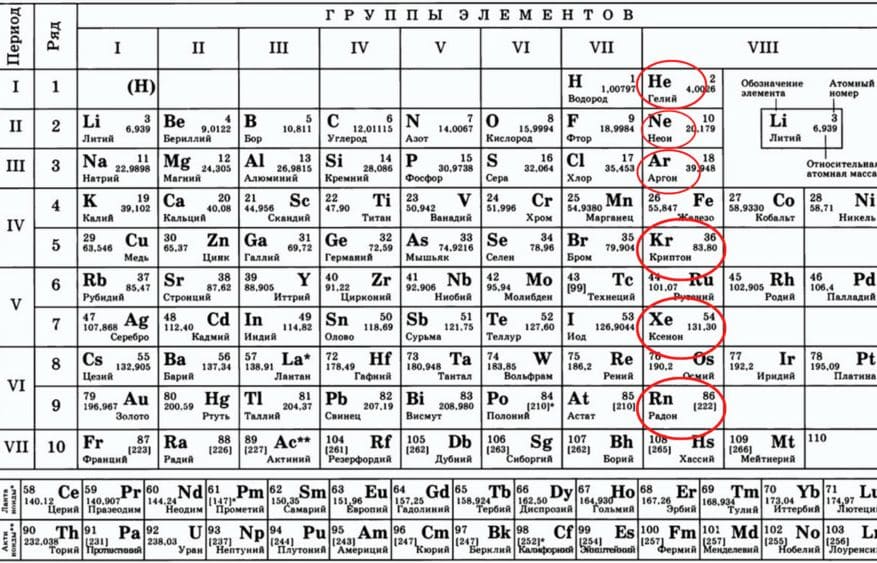
Найдите в периодической таблице благородные газы.
Ответ
Благородные газы − гелий, неон, аргон, криптон, ксенон, радон − располагаются в главной подгруппе VIII группы.
Задание №2
Перечислите все галогены в периодической таблице. Какой группе и какой подгруппе они принадлежат?
Ответ
Галогены: фтор, хлор, бром, йод, астат. Все эти элементы находятся в главной подгруппе VII группы.
Задание №3
Используя периодическую таблицу, дайте характеристику восьмого элемента Периодической системы.
Ответ
Кислород
1) располагается во втором периоде, в главной подгруппе VI группы
2) имеет порядковый номер 8
3) заряд ядра атома +8
4) число протонов в ядре атома − 8
5) число электронов − 8
6) атомная масса − 15,9994 а.е.м.
Задание №4
Опишите элемент, который находится в третьем периоде и III группе.
Ответ
Алюминий
1) порядковый номер − 13
2) заряд ядра атома +13
3) число протонов в ядре атома − 13
4) число электронов − 13
5) атомная масса − 26,9815 а.е.м.
Задание №5
По аналогии с I группой определите, какие элементы входят в состав главной и побочной подгрупп II группы.
Ответ
Элементы II группы главной подгруппы: бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba, радий Ra.
Элементы II группы побочной подгруппы: цинк Zn, кадмий Cd, ртуть Hg, коперниций Cn.
Задание №6
Найдите в периодической таблице:
а) элемент, атомная масса которого примерно равна порядковому номеру;
б) три элемента, относительные атомные массы которых в 2 раза больше их порядкового номера;
в) два элемента, названные в честь великих учёных – химиков или физиков;
г) два элемента, названные в честь небесных тел;
д) два элемента, названные в честь стран;
е) элемент, названный в честь мифологического персонажа;
ж) пять элементов, названия которых связаны с Россией.
Ответ
а) Водород H
Ar(H)=1, порядковый номер водорода 1.
б) Гелий He, углерод C, кислород O, сера S
Ar(He) = 4, 4 : 2 = 2, порядковый номер гелия − 2
Ar(C) = 12, 12 : 2 = 6, порядковый номер углерода − 6
Ar(O) = 16, 16 : 2 = 8, порядковый номер кислорода − 8
Ar(S) = 32, 32 : 2 = 16, порядковый номер серы − 16
в) Менделевий Md, эйнштейний Es
г) Уран U, нептуний Np
д) Германий Ge, франций Fr
е) Прометий Pm (в честь титана Прометея), ванадий V (в честь древнескандинавской богини красоты Ванадис)
ж) Рутений Ru (Ruthenia — латинское название Руси), дубний Db ( в честь российского центра по исследованиям в области ядерной физики, наукограда Дубны) , московий Mc, флеровий Fl (Флеровий назван в честь Лаборатории ядерных реакций имени Флерова), оганессон Og (в честь академика Юрия Оганесяна).
Задание №7
Составьте из обозначений химических элементов слова на английском языке: а) Moscow; б) carbon; в) water.
Ответ
а) Moscow: Mo (Молибден) − S (Сера) − Co (Кобальт) − W (Вольфрам)
б) carbon: C (Углерод) − Ar (Аргон) − B (Бор) − O (Кислород) − N (Азот)
в) water: W (Вольфрам) − At (Астат) − Er (Эрбий)
Задание №8
Как вы думаете, появится ли когда−нибудь в периодической таблице восьмой период? Приведите свои соображения.
Ответ
В периодической таблице может появиться восьмой период, если будет синтезирован изотоп с достаточно стабильным ядром и в достаточном количестве.
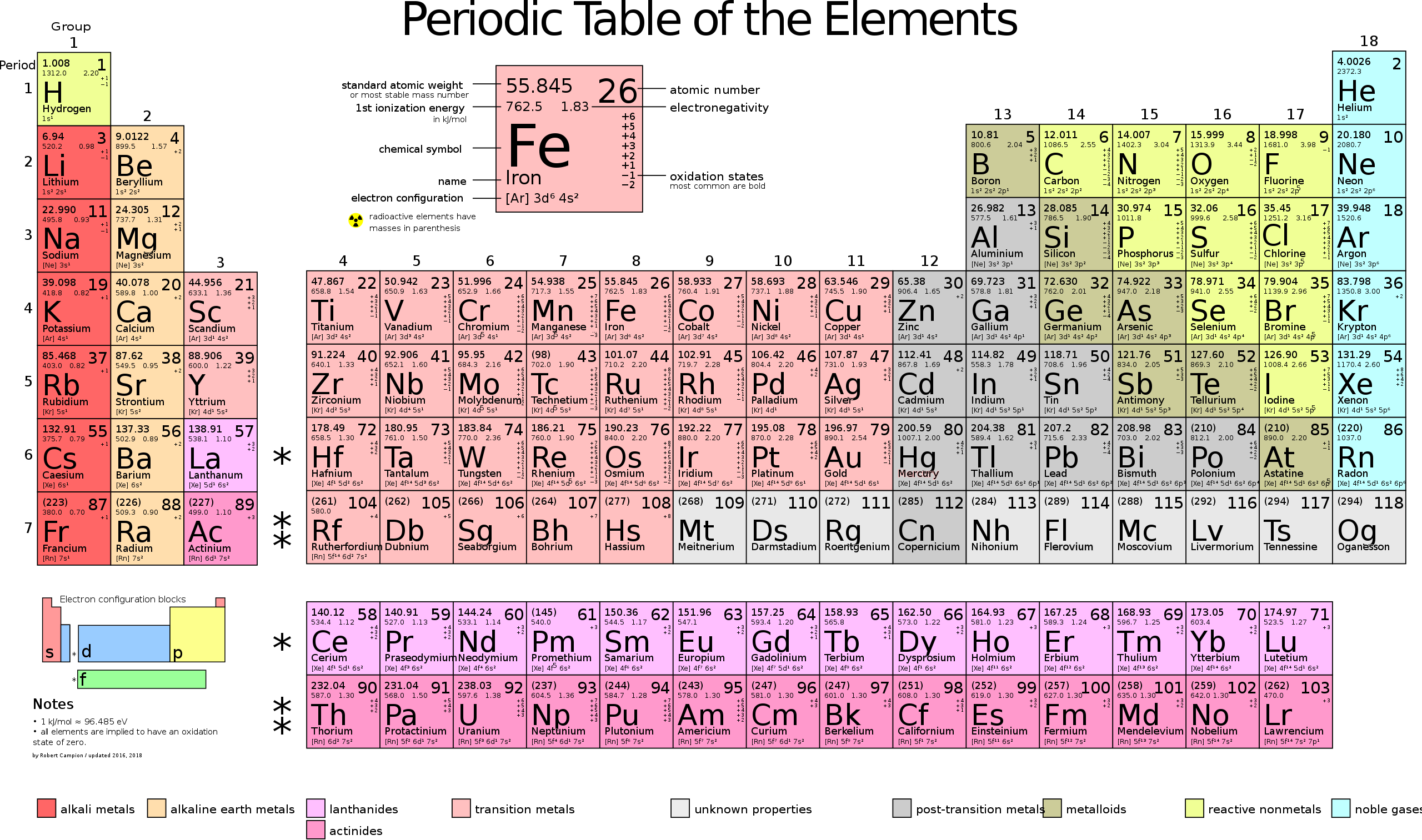
Первая периодическая таблица, получившая всеобщее признание, была разработана русским химиком Д. И. Менделеевым в 1869 и приведена к традиционному графическому виду в 1871 году. В современном варианте системы предполагается сведение элементов в двумерную таблицу, которая разделена на четыре примерно прямоугольные области, называемые блоками. Строки таблицы называются периодами, а столбцы называются группами. Элементы из одной и той же группы столбцов периодической таблицы имеют сходные химические характеристики.
История
В середине XIX века многие ученые пытались найти и выстроить некие закономерности среди открытых к тому времени 63 химических элементов.
В 1829 году Иоганном Дёберейнером был опубликован «закон триад», который гласил, что атомная масса многих элементов приблизительно равна среднему арифметическому двух других элементов, близких к исходному элементу по химическим свойствам. Так например, хлор, бром и йод образовали триаду; также как кальций, стронций и барий; литий, натрий и калий; и сера, селен и теллур.
В 1862 году Александр Эмиль Шанкуртуа решил расположить элементы в порядке возрастания атомных весов, разместив элементы на винтовой линии. Он отметил частое циклическое повторение химических свойств по вертикали. Так был создана модель «Земная спираль».
В 1864 году появилась таблица немецкого химика Юлиуса Лотара Мейера, разделенная на 6 столбцов, в которых располагались 28 элементов согласно их валентности.
В 1866 году английский химик и музыкант Джон Александр Ньюлендс описал «закон октав», сопоставив химические свойства элементов с их атомными массами. Расположив элементы в порядке возрастания их атомных масс, Ньюлендс заметил, что сходство в свойствах проявляется между каждым восьмым элементом, то есть как будто бы восьмой по порядку элемент повторяет свойства первого, как в музыке восьмая нота повторяет первую.
Окончательный прорыв был сделан русским химиком Дмитрием Менделеевым. 17 февраля 1869 года (1 марта 1869 года по григорианскому календарю), и Периодическая система химических элементов получила название «Опыт системы элементов, основанной на их атомном весе и химическом сходстве» [1] . Менделеев начал упорядочивать элементы и сравнивать их по их атомным весам. Он расставил элементы по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами периодов современной системы) и по шести вертикальным столбцам (прообразам будущих групп). Менделеев в своей таблице оставил несколько свободных мест и предсказал ряд фундаментальных свойств ещё не открытых элементов и само их существование, а также свойства их соединений (экабор, экаалюминий, экасилиций, экамарганец — соответственно, скандий, галлий, германий, технеций).
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, их свойства начинают повторяться. Например, натрий похож на калий, фтор похож на хлор, а золото — на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было в том, что основой для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеев предпринял очень смелые шаги: он исправил атомные массы некоторых элементов (например, бериллия, индия, урана, тория, церия, титана, иттрия), несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими (например, таллий, считавшийся щелочным металлом, он поместил в третью группу согласно его фактической максимальной валентности), оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
В 1871 году Менделеев опубликовал длинную статью в «Основах химии» (ч. 2, вып. 2), включающую обновленную форму своей таблицы, в которой были изложены его предсказания для неизвестных элементов. Эта таблица имела более привычный нам вид: горизонтальные ряды сходных элементов превратились в восемь вертикально расположенные группы; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
В начале XX века с открытием строения атома было установлено, что периодичность изменения свойств элементов определяется не атомным весом, а зарядом ядра, равным атомному номеру и числу электронов, распределение которых по электронным оболочкам атома элемента определяет его химические свойства. Заряд ядра, который соответствует номеру элемента в периодической системе, по праву назван числом Менделеева.
Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, в которые помещались всё новые и новые элементы: благородные газы, природные и искусственно полученные радиоактивные элементы.
В 2010 году с синтезом 118 элемента седьмой период периодической системы был завершён. Также есть ряд гипотетических элементов (с номерами от 119 до 126), которым присвоено временное систематическое название: Унуненний, Унбинилий, Унбиуний, Унбибий, Унбитрий, Унбиквадий, Унбипентий, Унбигексий. Предпринимались попытки получить некоторые из этих элементов (кроме 123 и 125), однако они успехом не увенчались. Проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии[2].
Структура
Наиболее распространёнными являются три формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная».
В «сверхдлинном» варианте каждый период занимает ровно одну строчку. Такая расширенн
«Сверхдлинный» вариант таблицы Менделеева
В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по две строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Водород помещён в 7-ю группу таблицы. Короткая форма таблицы была официально отменена ИЮПАК в 1989 году, но ее продолжают иногда использовать.
Существует несколько сотен вариантов таблицы, редко или вовсе не используемых, но весьма оригинальных, способов графического отображения Периодического закона. Например, Нильс Бор разрабатывал лестничную (пирамидальную) форму периодической системы. Многие учёные до сих пор предлагают всё новые варианты таблицы[3] [4].
Группы
Группа, или семейство — одна из колонок периодической таблицы. Для групп, как правило, характерны более выраженные периодические тенденции, нежели для периодов или блоков. Современные квантово-механические теории атомной структуры объясняют групповую общность тем, что элементы в пределах одной группы обыкновенно имеют одинаковые электронные конфигурации на их валентных оболочках. Соответственно, элементы, которые принадлежат к одной и той же группе, традиционно располагают схожими химическими особенностями и демонстрируют явную закономерность в изменении свойств по мере увеличения атомного числа. Впрочем, в некоторых областях таблицы, например, в d-блоке и f-блоке, горизонтальные сходства могут быть столь же важны или даже более заметно выражены, нежели вертикальные. [5] [6] [7] [8]
В соответствии с международной системой именования группам присваиваются номера от 1-го до 18-го в направлении слева направо — от щелочных металлов к благородным газам. Ранее для их идентификации использовались римские цифры.
Изменение свойств элементов в зависимости от положения в периодической таблице Менделеева. Стрелки указывают на повышение
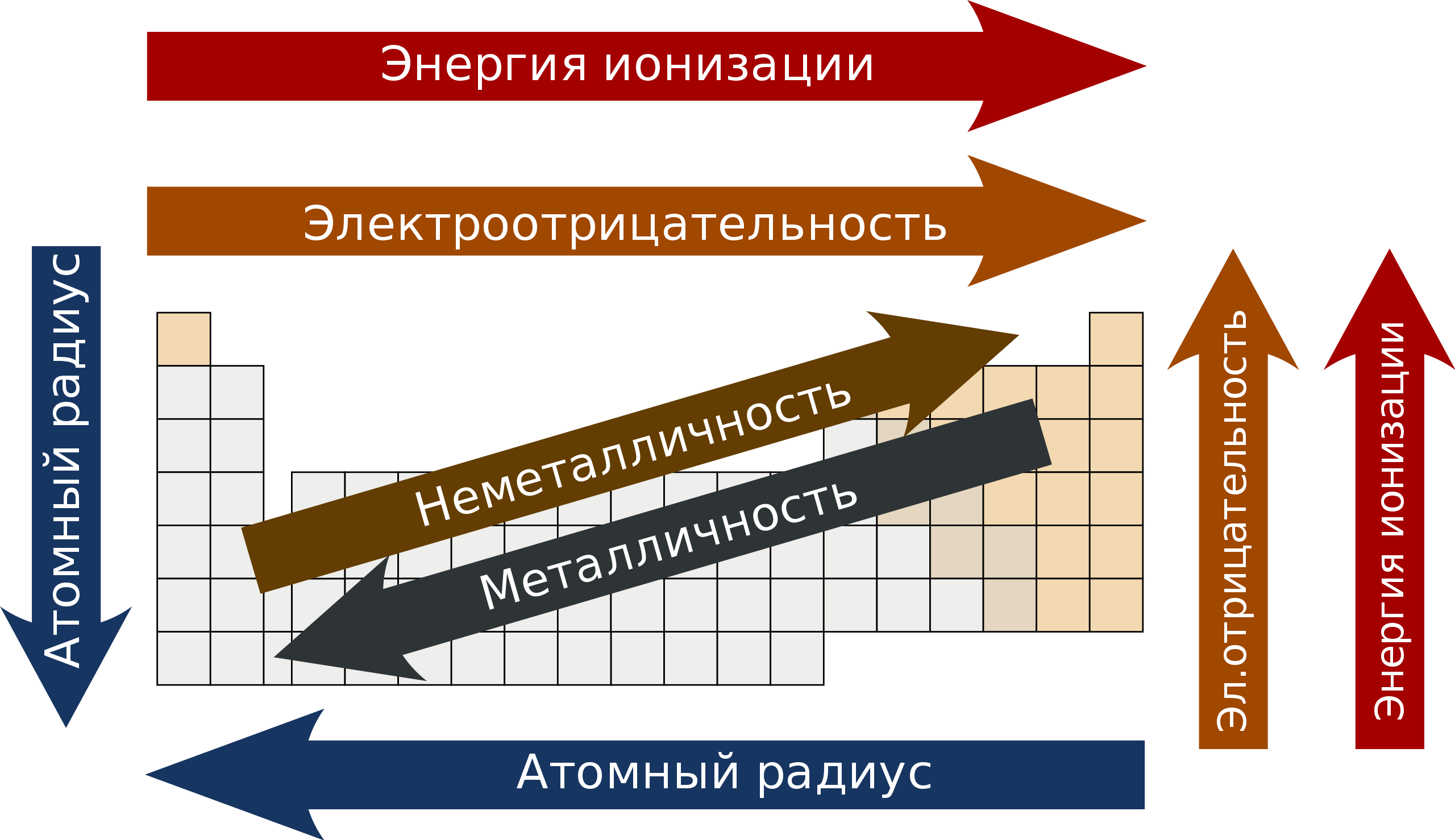
Изменение свойств элементов в зависимости от положения в периодической таблице Менделеева. Стрелки указывают на повышение
Элементы, относящиеся к одной группе, как правило, демонстрируют определённые тенденции по атомному радиусу, энергии ионизации и электроотрицательности. По направлению сверху вниз в рамках группы радиус атома возрастает (чем больше у него заполненных энергетических уровней, тем дальше от ядра располагаются валентные электроны), а энергия ионизации снижается (связи в атоме ослабевают, и, следовательно, изъять электрон становится проще), равно как и электроотрицательность (что, в свою очередь, также обусловлено возрастанием дистанции между валентными электронами и ядром). Случаются, впрочем, и исключения из этих закономерностей — к примеру, в группе 11 по направлению сверху вниз электроотрицательность возрастает, а не убывает.
Периоды
Период — строка периодической таблицы. Хотя для групп, как уже говорилось выше, характерны более существенные тенденции и закономерности, есть также области, где горизонтальное направление более значимо и показательно, нежели вертикальное — например, это касается f-блока, где лантаноиды и актиноиды образуют две важные горизонтальные последовательности элементов.
В рамках периода элементы демонстрируют определённые закономерности во всех трёх названных выше аспектах (атомный радиус, энергия ионизации и электроотрицательность), а также в энергии сродства к электрону. В направлении «слева направо» атомный радиус обычно сокращается (в силу того, что у каждого последующего элемента увеличивается количество заряженных частиц, и электроны притягиваются ближе к ядру), [9] и параллельно с ним возрастает энергия ионизации (чем сильнее связь в атоме, тем больше энергии требуется на изъятие электрона). Соответствующим образом увеличивается и электроотрицательность. Что касается энергии сродства к электрону, то металлы в левой части таблицы характеризуются меньшим значением этого показателя, а неметаллы в правой – большим (за исключением благородных газов). [10]
 Блоки
Блоки
Из-за значимости внешней электронной оболочки атома различные области периодической таблицы иногда описываются как блоки, именуемые в соответствии с тем, на какой оболочке находится последний электрон.
- s-блок включает первые две группы, то есть щелочные и щёлочноземельные металлы, а также водород и гелий;
- p-блок состоит из последних шести групп (с 13-й по 18-ю, согласно стандарту именования ИЮПАК) и включает, помимо других элементов, все металлоиды;
- d-блок — это группы с 3-й по 12-ю (ИЮПАК), в которые входят все переходные металлы;
- f-блок, выносимый обычно за пределы таблицы, состоит из лантаноидов и актиноидов[11].
Другие периодические закономерности
Помимо перечисленных выше, периодическому закону соответствуют и некоторые другие характеристики элементов:
Электронная конфигурация. Организация электронов демонстрирует определённый повторяющийся периодический образец. Электроны занимают последовательность оболочек, которые идентифицируются числами (оболочка 1, оболочка 2 и т. д.), а те, в свою очередь, состоят из подуровней s, p, d, f и g. По мере увеличения атомного числа электроны постепенно заполняют эти оболочки; каждый раз, когда электрон впервые занимает новую оболочку, начинается новый период в таблице. Сходства в электронной конфигурации обусловливают подобие свойств элементов (наблюдение за которыми, собственно, и привело к открытию периодического закона). [12][13]
Металличность/неметалличность. По мере снижения показателей энергии ионизации, электроотрицательности и энергии сродства к электрону элементы приобретают черты, характерные для металлов, а по мере их возрастания — напротив, для неметаллов. В соответствии с закономерностями для упомянутых характеристик, наиболее ярко выраженные металлы располагаются в начале периода, а неметаллы — в его конце. В группах, напротив, по мере движения сверху вниз металлические свойства усиливаются, хотя и с некоторыми исключениями из общего правила. Сочетание горизонтальных и вертикальных закономерностей придаёт условной разделительной линии между металлами и неметаллами ступенчатый вид; расположенные вдоль этой линии элементы иногда определяются как металлоиды.
Значение
Периодическая система Д. И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей было предсказано существование неизвестных науке химических элементов, установлено их положение относительно известных в таблице и их свойства. Позже многие элементы были обнаружены и встали на те места, которые предсказал Менделеев в своей таблице. [14]
Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях.
Прогнозирующая роль периодической системы, показанная ещё самим Менделеевым, в XX веке проявилась в оценке химических свойств трансурановых элементов.
Появление периодической системы и открытие периодического закона открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях. Д. И. Менделеевым и его последователями создана стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
Примечания
- Периодическая система элементов / Д. Н. Трифонов // Большая Советская Энциклопедия / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская Энциклопедия, 1975. — Т. 19 : Отоми — Пластырь. — С. 413—417
- Professor Witek Nazarewicz. Researchers Explore Limits of the Periodic Table of Elements. Sci-News.com (20 июня 2018)
- Трифонов Д. Н. Структура и границы периодической системы. — М.: Атомиздат, 1969. — 271 с.
- Химики предложили улучшить таблицу Менделеева. Lenta.Ru (7 октября 2009).
- Messler, R. W. The essence of materials for engineers (англ.). — Sudbury, MA: Jones & Bartlett Publishers (англ.)рус., 2010. — P. 32. — ISBN 0763778338.
- Bagnall, K. W. (1967), Recent advances in actinide and lanthanide chemistry, in Fields, PR & Moeller, T, Advances in chemistry, Lanthanide/Actinide chemistry, vol. 71, American Chemical Society, с. 1–12
- Day M. C., Selbin J. Theoretical inorganic chemistry (англ.). — 2nd. — New York, MA: Reinhold Book Corporation, 1969. — P. 103. — ISBN 0763778338
- Holman J., Hill G. C. Chemistry in context (англ.). — 5th. — Walton-on-Thames: Nelson Thornes, 2000. — P. 40. — ISBN 0174482760.
- Mascetta, Joseph. Chemistry The Easy Way. — 4th. — New York: Hauppauge, 2003. — С. 50. — ISBN 978-0-7641-1978-1.
- Kotz, John; Treichel, Paul; Townsend, John. Chemistry and Chemical Reactivity, Volume 2 (англ.). — 7th. — Belmont: Thomson Brooks/Cole, 2009. — P. 324. — ISBN 978-0-495-38712-1.
- Jones, Chris. d- and f-block chemistry. — New York: J. Wiley & Sons, 2002. — С. 2. — ISBN 978-0-471-22476-1.
- Chang, Raymond. Chemistry. — 7. — New York: McGraw-Hill Education, 2002. — С. 289—310; 340—42. — ISBN 0-07-112072-6.
- Yoder, C. H.; Suydam, F. H.; Snavely, F. A. Chemistry. — 2nd. — Harcourt Brace Jovanovich (англ.)рус., 1975. — С. 58. — ISBN 0-15-506465-7.
- Крицман В. А., Станцо В. В., Энциклопедический словарь юного химика, 1990, с. 180.
Литература
- Менделеев Д. И., —. Периодическая законность химических элементов // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Евдокимов Ю., кандидат химич. наук. К истории периодического закона. Наука и жизнь, № 5 (2009), С. 12-15.
- Агафошин Н. П. Периодический закон и периодическая система элементов Д. И. Менделеева. — М.: Просвещение, 1973. — 208 с.
- Дружинин П.А. Загадка «Таблицы Менделеева»: История публикации открытия Д.И. Менделеевым Периодического закона. — Москва: Новое Литературное Обозрение, 2019. — 164 с. — ISBN 978-5-4448-0976-1.
- Eric R. Scerri. The Periodic Table: Its Story and Its Significance. — N. Y.: Oxford University Press, 2007. — 368 с. — ISBN 978-0-19-530573-9.
- Крицман В. А., Станцо В. В. Энциклопедический словарь юного химика / Ведущий редактор Минина Т. П. — 2-е изд., испр. — М.: Педагогика, 1990. — 320 с. — (ЭС). — ISBN 5-7155-0292-6.
- Макареня А. А., Трифонов Д. Н. Периодический закон Д. И. Менделеева. — М.: Просвещение, 1969. — 160 с.
- Некрасов Б.В. Основы общей химии. — 3-е изд. — М.: Химия, 1973. — Т. 1. — 656 с.
- Реми Г. Курс неорганической химии. — М.: Изд-во иностранной лит-ры, 1963. — Т. 1. — 920 с.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.

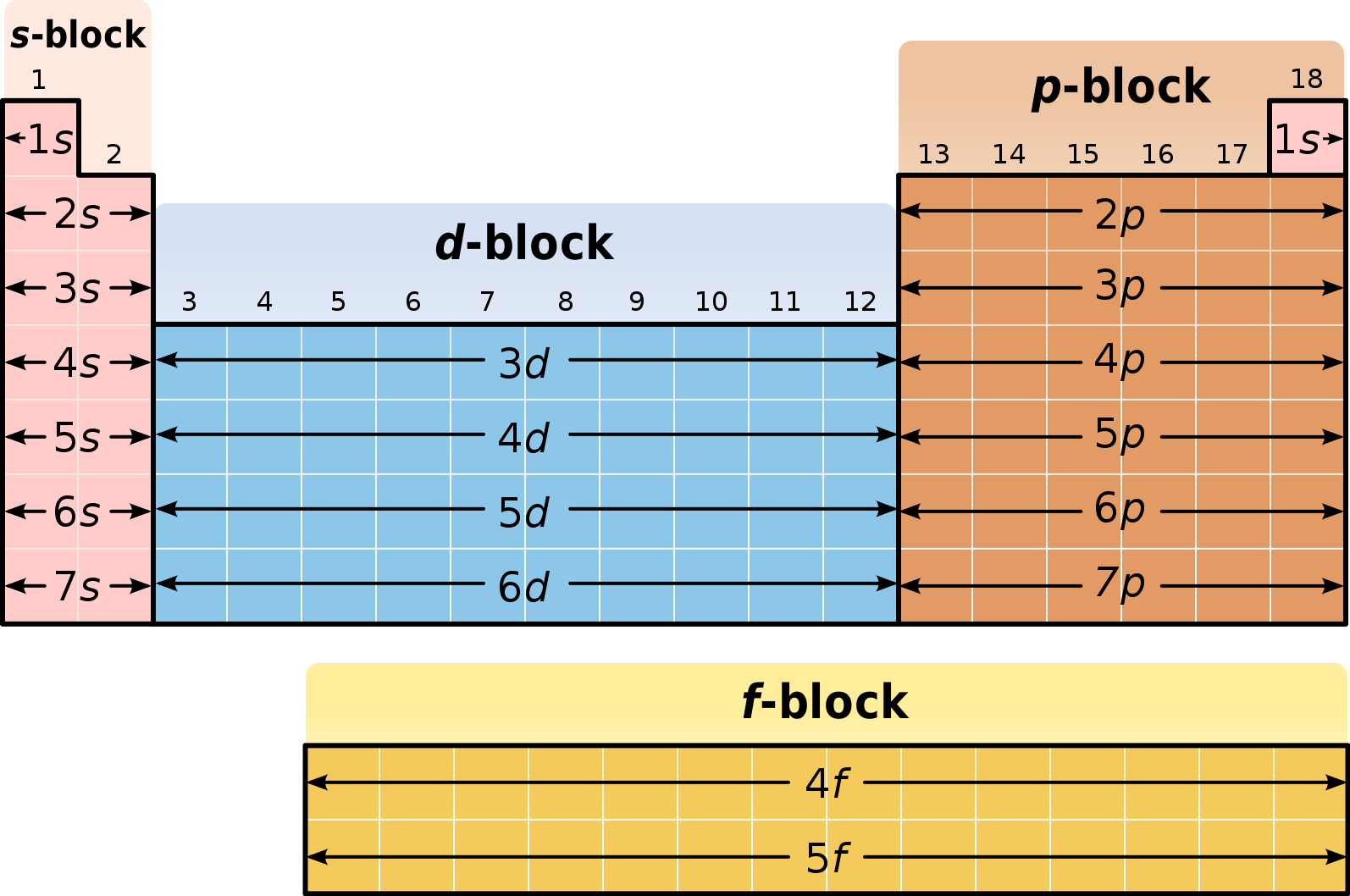 Блоки
Блоки 


