 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Copper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | red-orange metallic luster | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Cu) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Copper in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 29 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 11 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d10 4s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1357.77 K (1084.62 °C, 1984.32 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2835 K (2562 °C, 4643 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 8.96 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 8.02 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 13.26 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 300.4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 24.440 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −2, 0,[2] +1, +2, +3, +4 (a mildly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.90 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 128 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 132±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of copper |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | (annealed) 3810 m/s (at r.t.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 16.5 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 401 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 16.78 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −5.46×10−6 cm3/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 110–128 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 48 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 140 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 3.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hardness | 343–369 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 235–878 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-50-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Naming | after Cyprus, principal mining place in Roman era (Cyprium) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Middle East (9000 BC) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | «Cu»: from Latin cuprum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of copper
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Copper is a chemical element with the symbol Cu (from Latin: cuprum) and atomic number 29. It is a soft, malleable, and ductile metal with very high thermal and electrical conductivity. A freshly exposed surface of pure copper has a pinkish-orange color. Copper is used as a conductor of heat and electricity, as a building material, and as a constituent of various metal alloys, such as sterling silver used in jewelry, cupronickel used to make marine hardware and coins, and constantan used in strain gauges and thermocouples for temperature measurement.
Copper is one of the few metals that can occur in nature in a directly usable metallic form (native metals). This led to very early human use in several regions, from circa 8000 BC. Thousands of years later, it was the first metal to be smelted from sulfide ores, circa 5000 BC; the first metal to be cast into a shape in a mold, c. 4000 BC; and the first metal to be purposely alloyed with another metal, tin, to create bronze, c. 3500 BC.[5]
In the Roman era, copper was mined principally on Cyprus, the origin of the name of the metal, from aes cyprium (metal of Cyprus), later corrupted to cuprum (Latin). Coper (Old English) and copper were derived from this, the later spelling first used around 1530.[6]
Commonly encountered compounds are copper(II) salts, which often impart blue or green colors to such minerals as azurite, malachite, and turquoise, and have been used widely and historically as pigments.
Copper used in buildings, usually for roofing, oxidizes to form a green verdigris (or patina). Copper is sometimes used in decorative art, both in its elemental metal form and in compounds as pigments. Copper compounds are used as bacteriostatic agents, fungicides, and wood preservatives.
Copper is essential to all living organisms as a trace dietary mineral because it is a key constituent of the respiratory enzyme complex cytochrome c oxidase. In molluscs and crustaceans, copper is a constituent of the blood pigment hemocyanin, replaced by the iron-complexed hemoglobin in fish and other vertebrates. In humans, copper is found mainly in the liver, muscle, and bone.[7] The adult body contains between 1.4 and 2.1 mg of copper per kilogram of body weight.[8]
Characteristics
Physical
Copper just above its melting point keeps its pink luster color when enough light outshines the orange incandescence color
Copper, silver, and gold are in group 11 of the periodic table; these three metals have one s-orbital electron on top of a filled d-electron shell and are characterized by high ductility, and electrical and thermal conductivity. The filled d-shells in these elements contribute little to interatomic interactions, which are dominated by the s-electrons through metallic bonds. Unlike metals with incomplete d-shells, metallic bonds in copper are lacking a covalent character and are relatively weak. This observation explains the low hardness and high ductility of single crystals of copper.[9] At the macroscopic scale, introduction of extended defects to the crystal lattice, such as grain boundaries, hinders flow of the material under applied stress, thereby increasing its hardness. For this reason, copper is usually supplied in a fine-grained polycrystalline form, which has greater strength than monocrystalline forms.[10]
The softness of copper partly explains its high electrical conductivity (59.6×106 S/m) and high thermal conductivity, second highest (second only to silver) among pure metals at room temperature.[11] This is because the resistivity to electron transport in metals at room temperature originates primarily from scattering of electrons on thermal vibrations of the lattice, which are relatively weak in a soft metal.[9] The maximum permissible current density of copper in open air is approximately 3.1×106 A/m2 of cross-sectional area, above which it begins to heat excessively.[12]
Copper is one of a few metallic elements with a natural color other than gray or silver.[13] Pure copper is orange-red and acquires a reddish tarnish when exposed to air. The is due to the low plasma frequency of the metal, which lies in the red part of the visible spectrum, causing it to absorb the higher-frequency green and blue colors.[14]
As with other metals, if copper is put in contact with another metal, galvanic corrosion will occur.[15]
Chemical
Unoxidized copper wire (left) and oxidized copper wire (right)
The East Tower of the Royal Observatory, Edinburgh, showing the contrast between the refurbished copper installed in 2010 and the green color of the original 1894 copper.
Copper does not react with water, but it does slowly react with atmospheric oxygen to form a layer of brown-black copper oxide which, unlike the rust that forms on iron in moist air, protects the underlying metal from further corrosion (passivation). A green layer of verdigris (copper carbonate) can often be seen on old copper structures, such as the roofing of many older buildings[16] and the Statue of Liberty.[17] Copper tarnishes when exposed to some sulfur compounds, with which it reacts to form various copper sulfides.[18]
Isotopes
There are 29 isotopes of copper. 63
Cu
and 65
Cu
are stable, with 63
Cu
comprising approximately 69% of naturally occurring copper; both have a spin of 3⁄2.[19] The other isotopes are radioactive, with the most stable being 67
Cu
with a half-life of 61.83 hours.[19] Seven metastable isotopes have been characterized; 68m
Cu
is the longest-lived with a half-life of 3.8 minutes. Isotopes with a mass number above 64 decay by β−, whereas those with a mass number below 64 decay by β+. 64
Cu
, which has a half-life of 12.7 hours, decays both ways.[20]
62
Cu
and 64
Cu
have significant applications. 62
Cu
is used in 62
Cu
Cu-PTSM as a radioactive tracer for positron emission tomography.[21]
Occurrence
Native copper from the Keweenaw Peninsula, Michigan, about 2.5 inches (6.4 cm) long
Copper is produced in massive stars[22] and is present in the Earth’s crust in a proportion of about 50 parts per million (ppm).[23] In nature, copper occurs in a variety of minerals, including native copper, copper sulfides such as chalcopyrite, bornite, digenite, covellite, and chalcocite, copper sulfosalts such as tetrahedite-tennantite, and enargite, copper carbonates such as azurite and malachite, and as copper(I) or copper(II) oxides such as cuprite and tenorite, respectively.[11] The largest mass of elemental copper discovered weighed 420 tonnes and was found in 1857 on the Keweenaw Peninsula in Michigan, US.[23] Native copper is a polycrystal, with the largest single crystal ever described measuring 4.4 × 3.2 × 3.2 cm.[24] Copper is the 25th most abundant element in Earth’s crust, representing 50 ppm compared with 75 ppm for zinc, and 14 ppm for lead.[25]
Typical background concentrations of copper do not exceed 1 ng/m3 in the atmosphere; 150 mg/kg in soil; 30 mg/kg in vegetation; 2 μg/L in freshwater and 0.5 μg/L in seawater.[26]
Production
Most copper is mined or extracted as copper sulfides from large open pit mines in porphyry copper deposits that contain 0.4 to 1.0% copper. Sites include Chuquicamata, in Chile, Bingham Canyon Mine, in Utah, United States, and El Chino Mine, in New Mexico, United States. According to the British Geological Survey, in 2005, Chile was the top producer of copper with at least one-third of the world share followed by the United States, Indonesia and Peru.[11] Copper can also be recovered through the in-situ leach process. Several sites in the state of Arizona are considered prime candidates for this method.[27] The amount of copper in use is increasing and the quantity available is barely sufficient to allow all countries to reach developed world levels of usage.[28] An alternative source of copper for collection currently being researched are polymetallic nodules, which are located at the depths of the Pacific Ocean approximately 3000–6500 meters below sea level. These nodules contain other valuable metals such as cobalt and nickel.[29]
Reserves and prices
Price of Copper 1959-2022
Copper has been in use at least 10,000 years, but more than 95% of all copper ever mined and smelted has been extracted since 1900.[30] As with many natural resources, the total amount of copper on Earth is vast, with around 1014 tons in the top kilometer of Earth’s crust, which is about 5 million years’ worth at the current rate of extraction. However, only a tiny fraction of these reserves is economically viable with present-day prices and technologies. Estimates of copper reserves available for mining vary from 25 to 60 years, depending on core assumptions such as the growth rate.[31] Recycling is a major source of copper in the modern world.[30] Because of these and other factors, the future of copper production and supply is the subject of much debate, including the concept of peak copper, analogous to peak oil.[citation needed]
The price of copper has historically been unstable,[32] and its price increased from the 60-year low of US$0.60/lb (US$1.32/kg) in June 1999 to $3.75 per pound ($8.27/kg) in May 2006. It dropped to $2.40/lb ($5.29/kg) in February 2007, then rebounded to $3.50/lb ($7.71/kg) in April 2007.[33][better source needed] In February 2009, weakening global demand and a steep fall in commodity prices since the previous year’s highs left copper prices at $1.51/lb ($3.32/kg).[34] Between September 2010 and February 2011, the price of copper rose from £5,000 a metric ton to £6,250 a metric ton.[35]
Methods
Scheme of flash smelting process
The concentration of copper in ores averages only 0.6%, and most commercial ores are sulfides, especially chalcopyrite (CuFeS2), bornite (Cu5FeS4) and, to a lesser extent, covellite (CuS) and chalcocite (Cu2S).[36] Conversely, the average concentration of copper in polymetallic nodules is estimated at 1.3%. The methods of extracting copper as well as other metals found in these nodules include sulphuric leaching, smelting and an application of the Cuprion process.[37][38] For minerals found in land ores, they are concentrated from crushed ores to the level of 10–15% copper by froth flotation or bioleaching.[39] Heating this material with silica in flash smelting removes much of the iron as slag. The process exploits the greater ease of converting iron sulfides into oxides, which in turn react with the silica to form the silicate slag that floats on top of the heated mass. The resulting copper matte, consisting of Cu2S, is roasted to convert the sulfides into oxides:[36]
- 2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2
The cuprous oxide reacts with cuprous sulfide to converted to blister copper upon heating:
- 2 Cu2O + Cu2S → 6 Cu + 2 SO2
The Sudbury matte process converted only half the sulfide to oxide and then used this oxide to remove the rest of the sulfur as oxide. It was then electrolytically refined and the anode mud exploited for the platinum and gold it contained. This step exploits the relatively easy reduction of copper oxides to copper metal. Natural gas is blown across the blister to remove most of the remaining oxygen and electrorefining is performed on the resulting material to produce pure copper:[40]
- Cu2+ + 2 e− → Cu

Recycling
Like aluminium,[41] copper is recyclable without any loss of quality, both from raw state and from manufactured products.[42] In volume, copper is the third most recycled metal after iron and aluminium.[43] An estimated 80% of all copper ever mined is still in use today.[44] According to the International Resource Panel’s Metal Stocks in Society report, the global per capita stock of copper in use in society is 35–55 kg. Much of this is in more-developed countries (140–300 kg per capita) rather than less-developed countries (30–40 kg per capita).
The process of recycling copper is roughly the same as is used to extract copper but requires fewer steps. High-purity scrap copper is melted in a furnace and then reduced and cast into billets and ingots; lower-purity scrap is refined by electroplating in a bath of sulfuric acid.[45]
Alloys
Copper alloys are widely used in the production of coinage; seen here are two examples — post-1964 American dimes, which are composed of the alloy cupronickel[46] and a pre-1968 Canadian dime, which is composed of an alloy of 80 percent silver and 20 percent copper.[47]
Numerous copper alloys have been formulated, many with important uses. Brass is an alloy of copper and zinc. Bronze usually refers to copper-tin alloys, but can refer to any alloy of copper such as aluminium bronze. Copper is one of the most important constituents of silver and karat gold solders used in the jewelry industry, modifying the color, hardness and melting point of the resulting alloys.[48] Some lead-free solders consist of tin alloyed with a small proportion of copper and other metals.[49]
The alloy of copper and nickel, called cupronickel, is used in low-denomination coins, often for the outer cladding. The US five-cent coin (currently called a nickel) consists of 75% copper and 25% nickel in homogeneous composition. Prior to the introduction of cupronickel, which was widely adopted by countries in the latter half of the 20th century,[50] alloys of copper and silver were also used, with the United States using an alloy of 90% silver and 10% copper until 1965, when circulating silver was removed from all coins with the exception of the Half dollar — these were debased to an alloy of 40% silver and 60% copper between 1965 and 1970.[51] The alloy of 90% copper and 10% nickel, remarkable for its resistance to corrosion, is used for various objects exposed to seawater, though it is vulnerable to the sulfides sometimes found in polluted harbors and estuaries.[52] Alloys of copper with aluminium (about 7%) have a golden color and are used in decorations.[23] Shakudō is a Japanese decorative alloy of copper containing a low percentage of gold, typically 4–10%, that can be patinated to a dark blue or black color.[53]
Compounds
Copper forms a rich variety of compounds, usually with oxidation states +1 and +2, which are often called cuprous and cupric, respectively.[54] Copper compounds, whether organic complexes or organometallics, promote or catalyse numerous chemical and biological processes.[55]
Binary compounds
As with other elements, the simplest compounds of copper are binary compounds, i.e. those containing only two elements, the principal examples being oxides, sulfides, and halides. Both cuprous and cupric oxides are known. Among the numerous copper sulfides, important examples include copper(I) sulfide and copper(II) sulfide.[citation needed]
Cuprous halides with fluorine, chlorine, bromine, and iodine are known, as are cupric halides with fluorine, chlorine, and bromine. Attempts to prepare copper(II) iodide yield only copper(I) iodide and iodine.[54]
- 2 Cu2+ + 4 I− → 2 CuI + I2
Coordination chemistry
Copper forms coordination complexes with ligands. In aqueous solution, copper(II) exists as [Cu(H
2O)
6]2+
. This complex exhibits the fastest water exchange rate (speed of water ligands attaching and detaching) for any transition metal aquo complex. Adding aqueous sodium hydroxide causes the precipitation of light blue solid copper(II) hydroxide. A simplified equation is:
Pourbaix diagram for copper in uncomplexed media (anions other than OH- not considered). Ion concentration 0.001 m (mol/kg water). Temperature 25 °C.
- Cu2+ + 2 OH− → Cu(OH)2
Aqueous ammonia results in the same precipitate. Upon adding excess ammonia, the precipitate dissolves, forming tetraamminecopper(II):
- Cu(H
2O)
4(OH)
2 + 4 NH3 → [Cu(H
2O)
2(NH
3)
4]2+
+ 2 H2O + 2 OH−
Many other oxyanions form complexes; these include copper(II) acetate, copper(II) nitrate, and copper(II) carbonate. Copper(II) sulfate forms a blue crystalline pentahydrate, the most familiar copper compound in the laboratory. It is used in a fungicide called the Bordeaux mixture.[56]
Polyols, compounds containing more than one alcohol functional group, generally interact with cupric salts. For example, copper salts are used to test for reducing sugars. Specifically, using Benedict’s reagent and Fehling’s solution the presence of the sugar is signaled by a color change from blue Cu(II) to reddish copper(I) oxide.[57] Schweizer’s reagent and related complexes with ethylenediamine and other amines dissolve cellulose.[58] Amino acids such as cystine form very stable chelate complexes with copper(II)[59][60][61] including in the form of metal-organic biohybrids (MOBs). Many wet-chemical tests for copper ions exist, one involving potassium ferrocyanide, which gives a brown precipitate with copper(II) salts.[citation needed]
Organocopper chemistry
Compounds that contain a carbon-copper bond are known as organocopper compounds. They are very reactive towards oxygen to form copper(I) oxide and have many uses in chemistry. They are synthesized by treating copper(I) compounds with Grignard reagents, terminal alkynes or organolithium reagents;[62] in particular, the last reaction described produces a Gilman reagent. These can undergo substitution with alkyl halides to form coupling products; as such, they are important in the field of organic synthesis. Copper(I) acetylide is highly shock-sensitive but is an intermediate in reactions such as the Cadiot-Chodkiewicz coupling[63] and the Sonogashira coupling.[64] Conjugate addition to enones[65] and carbocupration of alkynes[66] can also be achieved with organocopper compounds. Copper(I) forms a variety of weak complexes with alkenes and carbon monoxide, especially in the presence of amine ligands.[67]
Copper(III) and copper(IV)
Copper(III) is most often found in oxides. A simple example is potassium cuprate, KCuO2, a blue-black solid.[68] The most extensively studied copper(III) compounds are the cuprate superconductors. Yttrium barium copper oxide (YBa2Cu3O7) consists of both Cu(II) and Cu(III) centres. Like oxide, fluoride is a highly basic anion[69] and is known to stabilize metal ions in high oxidation states. Both copper(III) and even copper(IV) fluorides are known, K3CuF6 and Cs2CuF6, respectively.[54]
Some copper proteins form oxo complexes, which also feature copper(III).[70] With tetrapeptides, purple-colored copper(III) complexes are stabilized by the deprotonated amide ligands.[71]
Complexes of copper(III) are also found as intermediates in reactions of organocopper compounds.[72] For example, in the Kharasch–Sosnovsky reaction.[citation needed]
History
A timeline of copper illustrates how this metal has advanced human civilization for the past 11,000 years.[73]
Prehistoric
Copper Age
A corroded copper ingot from Zakros, Crete, shaped in the form of an animal skin (oxhide) typical in that era.
Many tools during the Chalcolithic Era included copper, such as the blade of this replica of Ötzi’s axe
Copper occurs naturally as native metallic copper and was known to some of the oldest civilizations on record. The history of copper use dates to 9000 BC in the Middle East;[74] a copper pendant was found in northern Iraq that dates to 8700 BC.[75] Evidence suggests that gold and meteoric iron (but not smelted iron) were the only metals used by humans before copper.[76] The history of copper metallurgy is thought to follow this sequence: First, cold working of native copper, then annealing, smelting, and, finally, lost-wax casting. In southeastern Anatolia, all four of these techniques appear more or less simultaneously at the beginning of the Neolithic c. 7500 BC.[77]
Copper smelting was independently invented in different places. It was probably discovered in China before 2800 BC, in Central America around 600 AD, and in West Africa about the 9th or 10th century AD.[78] Investment casting was invented in 4500–4000 BC in Southeast Asia[74] and carbon dating has established mining at Alderley Edge in Cheshire, UK, at 2280 to 1890 BC.[79] Ötzi the Iceman, a male dated from 3300 to 3200 BC, was found with an axe with a copper head 99.7% pure; high levels of arsenic in his hair suggest an involvement in copper smelting.[80] Experience with copper has assisted the development of other metals; in particular, copper smelting led to the discovery of iron smelting.[80] Production in the Old Copper Complex in Michigan and Wisconsin is dated between 6000 and 3000 BC.[81][82] Natural bronze, a type of copper made from ores rich in silicon, arsenic, and (rarely) tin, came into general use in the Balkans around 5500 BC.[83]
Bronze Age
Alloying copper with tin to make bronze was first practiced about 4000 years after the discovery of copper smelting, and about 2000 years after «natural bronze» had come into general use.[84] Bronze artifacts from the Vinča culture date to 4500 BC.[85] Sumerian and Egyptian artifacts of copper and bronze alloys date to 3000 BC.[86] The Bronze Age began in Southeastern Europe around 3700–3300 BC, in Northwestern Europe about 2500 BC. It ended with the beginning of the Iron Age, 2000–1000 BC in the Near East, and 600 BC in Northern Europe. The transition between the Neolithic period and the Bronze Age was formerly termed the Chalcolithic period (copper-stone), when copper tools were used with stone tools. The term has gradually fallen out of favor because in some parts of the world, the Chalcolithic and Neolithic are coterminous at both ends. Brass, an alloy of copper and zinc, is of much more recent origin. It was known to the Greeks, but became a significant supplement to bronze during the Roman Empire.[86]
Ancient and post-classical
In alchemy the symbol for copper was also the symbol for the goddess and planet Venus.
In Greece, copper was known by the name chalkos (χαλκός). It was an important resource for the Romans, Greeks and other ancient peoples. In Roman times, it was known as aes Cyprium, aes being the generic Latin term for copper alloys and Cyprium from Cyprus, where much copper was mined. The phrase was simplified to cuprum, hence the English copper. Aphrodite (Venus in Rome) represented copper in mythology and alchemy because of its lustrous beauty and its ancient use in producing mirrors; Cyprus, the source of copper, was sacred to the goddess. The seven heavenly bodies known to the ancients were associated with the seven metals known in antiquity, and Venus was assigned to copper, both because of the connection to the goddess and because Venus was the brightest heavenly body after the Sun and Moon and so corresponded to the most lustrous and desirable metal after gold and silver.[87]
Copper was first mined in ancient Britain as early as 2100 BC. Mining at the largest of these mines, the Great Orme, continued into the late Bronze Age. Mining seems to have been largely restricted to supergene ores, which were easier to smelt. The rich copper deposits of Cornwall seem to have been largely untouched, in spite of extensive tin mining in the region, for reasons likely social and political rather than technological.[88]
In North America, copper mining began with marginal workings by Native Americans. Native copper is known to have been extracted from sites on Isle Royale with primitive stone tools between 800 and 1600.[89] Copper metallurgy was flourishing in South America, particularly in Peru around 1000 AD. Copper burial ornamentals from the 15th century have been uncovered, but the metal’s commercial production did not start until the early 20th century.[citation needed]
The cultural role of copper has been important, particularly in currency. Romans in the 6th through 3rd centuries BC used copper lumps as money. At first, the copper itself was valued, but gradually the shape and look of the copper became more important. Julius Caesar had his own coins made from brass, while Octavianus Augustus Caesar’s coins were made from Cu-Pb-Sn alloys. With an estimated annual output of around 15,000 t, Roman copper mining and smelting activities reached a scale unsurpassed until the time of the Industrial Revolution; the provinces most intensely mined were those of Hispania, Cyprus and in Central Europe.[90][91]
The gates of the Temple of Jerusalem used Corinthian bronze treated with depletion gilding.[clarification needed][citation needed] The process was most prevalent in Alexandria, where alchemy is thought to have begun.[92] In ancient India, copper was used in the holistic medical science Ayurveda for surgical instruments and other medical equipment. Ancient Egyptians (~2400 BC) used copper for sterilizing wounds and drinking water, and later to treat headaches, burns, and itching.[citation needed]
Modern
18th-century copper kettle from Norway made from Swedish copper
The Great Copper Mountain was a mine in Falun, Sweden, that operated from the 10th century to 1992. It satisfied two-thirds of Europe’s copper consumption in the 17th century and helped fund many of Sweden’s wars during that time.[93] It was referred to as the nation’s treasury; Sweden had a copper backed currency.[94]
Chalcography of the city of Vyborg at the turn of the 17th and 18th centuries. The year 1709 carved on the printing plate.
Copper is used in roofing,[16] currency, and for photographic technology known as the daguerreotype. Copper was used in Renaissance sculpture, and was used to construct the Statue of Liberty; copper continues to be used in construction of various types. Copper plating and copper sheathing were widely used to protect the under-water hulls of ships, a technique pioneered by the British Admiralty in the 18th century.[95] The Norddeutsche Affinerie in Hamburg was the first modern electroplating plant, starting its production in 1876.[96] The German scientist Gottfried Osann invented powder metallurgy in 1830 while determining the metal’s atomic mass; around then it was discovered that the amount and type of alloying element (e.g., tin) to copper would affect bell tones.[citation needed]
During the rise in demand for copper for the Age of Electricity, from the 1880s until the Great Depression of the 1930s, the United States produced one third to half the world’s newly mined copper.[97] Major districts included the Keweenaw district of northern Michigan, primarily native copper deposits, which was eclipsed by the vast sulphide deposits of Butte, Montana in the late 1880s, which itself was eclipsed by porphyry deposits of the Souhwest United States, especially at Bingham Canyon, Utah and Morenci, Arizona. Introduction of open pit steam shovel mining and innovations in smelting, refining, flotation concentration and other processing steps led to mass production. Early in the twentieth century, Arizona ranked first, followed by Montana, then Utah and Michigan.[98]
Flash smelting was developed by Outokumpu in Finland and first applied at Harjavalta in 1949; the energy-efficient process accounts for 50% of the world’s primary copper production.[99]
The Intergovernmental Council of Copper Exporting Countries, formed in 1967 by Chile, Peru, Zaire and Zambia, operated in the copper market as OPEC does in oil, though it never achieved the same influence, particularly because the second-largest producer, the United States, was never a member; it was dissolved in 1988.[100]
Applications
Copper fittings for soldered plumbing joints
The major applications of copper are electrical wire (60%), roofing and plumbing (20%), and industrial machinery (15%). Copper is used mostly as a pure metal, but when greater hardness is required, it is put into such alloys as brass and bronze (5% of total use).[23] For more than two centuries, copper paint has been used on boat hulls to control the growth of plants and shellfish.[101] A small part of the copper supply is used for nutritional supplements and fungicides in agriculture.[56][102] Machining of copper is possible, although alloys are preferred for good machinability in creating intricate parts.
Wire and cable
Despite competition from other materials, copper remains the preferred electrical conductor in nearly all categories of electrical wiring except overhead electric power transmission where aluminium is often preferred.[103][104] Copper wire is used in power generation, power transmission, power distribution, telecommunications, electronics circuitry, and countless types of electrical equipment.[105] Electrical wiring is the most important market for the copper industry.[106] This includes structural power wiring, power distribution cable, appliance wire, communications cable, automotive wire and cable, and magnet wire. Roughly half of all copper mined is used for electrical wire and cable conductors.[107] Many electrical devices rely on copper wiring because of its multitude of inherent beneficial properties, such as its high electrical conductivity, tensile strength, ductility, creep (deformation) resistance, corrosion resistance, low thermal expansion, high thermal conductivity, ease of soldering, malleability, and ease of installation.
For a short period from the late 1960s to the late 1970s, copper wiring was replaced by aluminium wiring in many housing construction projects in America. The new wiring was implicated in a number of house fires and the industry returned to copper.[108]
Electronics and related devices
Copper electrical busbars distributing power to a large building
Integrated circuits and printed circuit boards increasingly feature copper in place of aluminium because of its superior electrical conductivity; heat sinks and heat exchangers use copper because of its superior heat dissipation properties. Electromagnets, vacuum tubes, cathode ray tubes, and magnetrons in microwave ovens use copper, as do waveguides for microwave radiation.[109]
Electric motors
Copper’s superior conductivity enhances the efficiency of electrical motors.[110] This is important because motors and motor-driven systems account for 43%–46% of all global electricity consumption and 69% of all electricity used by industry.[111] Increasing the mass and cross section of copper in a coil increases the efficiency of the motor. Copper motor rotors, a new technology designed for motor applications where energy savings are prime design objectives,[112][113] are enabling general-purpose induction motors to meet and exceed National Electrical Manufacturers Association (NEMA) premium efficiency standards.[114]
Renewable energy production
Renewable energy sources such as solar, wind, tidal, hydro, biomass, and geothermal have become significant sectors of the energy market.[115][116] The rapid growth of these sources in the 21st century has been prompted by increasing costs of fossil fuels as well as their environmental impact issues that significantly lowered their use.
Copper plays an important role in these renewable energy systems.[117][118][119][120][121] Copper usage averages up to five times more in renewable energy systems than in traditional power generation, such as fossil fuel and nuclear power plants.[122] Since copper is an excellent thermal and electrical conductor among engineering metals (second only to silver),[123] electrical systems that utilize copper generate and transmit energy with high efficiency and with minimum environmental impacts.
When choosing electrical conductors, facility planners and engineers factor capital investment costs of materials against operational savings due to their electrical energy efficiencies over their useful lives, plus maintenance costs. Copper often fares well in these calculations. A factor called «copper usage intensity,” is a measure of the quantity of copper necessary to install one megawatt of new power-generating capacity.
Copper wires for recycling
When planning for a new renewable power facility, engineers and product specifiers seek to avoid supply shortages of selected materials. According to the United States Geological Survey, in-ground copper reserves have increased more than 700% since 1950, from almost 100 million tonnes to 720 million tonnes in 2017, despite the fact that world refined usage has more than tripled in the last 50 years.[124] Copper resources are estimated to exceed 5,000 million tonnes.[125][126]
Bolstering the supply from copper extraction is the fact that more than 30 percent of copper installed during the last decade came from recycled sources.[127] Its recycling rate is higher than any other metal.[128]
This article discusses the role of copper in various renewable energy generation systems.
Architecture
Old copper utensils in a Jerusalem restaurant
Copper has been used since ancient times as a durable, corrosion resistant, and weatherproof architectural material.[129][130][131][132] Roofs, flashings, rain gutters, downspouts, domes, spires, vaults, and doors have been made from copper for hundreds or thousands of years. Copper’s architectural use has been expanded in modern times to include interior and exterior wall cladding, building expansion joints, radio frequency shielding, and antimicrobial and decorative indoor products such as attractive handrails, bathroom fixtures, and counter tops. Some of copper’s other important benefits as an architectural material include low thermal movement, light weight, lightning protection, and recyclability
The metal’s distinctive natural green patina has long been coveted by architects and designers. The final patina is a particularly durable layer that is highly resistant to atmospheric corrosion, thereby protecting the underlying metal against further weathering.[133][134][135] It can be a mixture of carbonate and sulfate compounds in various amounts, depending upon environmental conditions such as sulfur-containing acid rain.[136][137][138][139] Architectural copper and its alloys can also be ‘finished’ to take on a particular look, feel, or color. Finishes include mechanical surface treatments, chemical coloring, and coatings.[140]
Copper has excellent brazing and soldering properties and can be welded; the best results are obtained with gas metal arc welding.[141]
Antibiofouling
Copper is biostatic, meaning bacteria and many other forms of life will not grow on it. For this reason it has long been used to line parts of ships to protect against barnacles and mussels. It was originally used pure, but has since been superseded by Muntz metal and copper-based paint. Similarly, as discussed in copper alloys in aquaculture, copper alloys have become important netting materials in the aquaculture industry because they are antimicrobial and prevent biofouling, even in extreme conditions[142] and have strong structural and corrosion-resistant[143] properties in marine environments.
Antimicrobial
Copper-alloy touch surfaces have natural properties that destroy a wide range of microorganisms (e.g., E. coli O157:H7, methicillin-resistant Staphylococcus aureus (MRSA), Staphylococcus, Clostridium difficile, influenza A virus, adenovirus, SARS-Cov-2, and fungi).[144][145] Indians have been using copper vessels since ancient times for storing water, even before modern science realized its antimicrobial properties.[146] Some copper alloys were proven to kill more than 99.9% of disease-causing bacteria within just two hours when cleaned regularly.[147] The United States Environmental Protection Agency (EPA) has approved the registrations of these copper alloys as «antimicrobial materials with public health benefits»;[147] that approval allows manufacturers to make legal claims to the public health benefits of products made of registered alloys. In addition, the EPA has approved a long list of antimicrobial copper products made from these alloys, such as bedrails, handrails, over-bed tables, sinks, faucets, door knobs, toilet hardware, computer keyboards, health club equipment, and shopping cart handles (for a comprehensive list, see: Antimicrobial copper-alloy touch surfaces#Approved products). Copper doorknobs are used by hospitals to reduce the transfer of disease, and Legionnaires’ disease is suppressed by copper tubing in plumbing systems.[148] Antimicrobial copper alloy products are now being installed in healthcare facilities in the U.K., Ireland, Japan, Korea, France, Denmark, and Brazil, as well as being called for in the US,[149] and in the subway transit system in Santiago, Chile, where copper-zinc alloy handrails were installed in some 30 stations between 2011 and 2014.[150][151][152]
Textile fibers can be blended with copper to create antimicrobial protective fabrics.[153][unreliable source?]
Speculative investing
Copper may be used as a speculative investment due to the predicted increase in use from worldwide infrastructure growth, and the important role it has in producing wind turbines, solar panels, and other renewable energy sources.[154][155] Another reason predicted demand increases is the fact that electric cars contain an average of 3.6 times as much copper as conventional cars, although the effect of electric cars on copper demand is debated.[156][157] Some people invest in copper through copper mining stocks, ETFs, and futures. Others store physical copper in the form of copper bars or rounds although these tend to carry a higher premium in comparison to precious metals.[158] Those who want to avoid the premiums of copper bullion alternatively store old copper wire, copper tubing or American pennies made before 1982.[159]
Folk medicine
Copper is commonly used in jewelry, and according to some folklore, copper bracelets relieve arthritis symptoms.[160] In one trial for osteoarthritis and one trial for rheumatoid arthritis, no differences is found between copper bracelet and control (non-copper) bracelet.[161][162] No evidence shows that copper can be absorbed through the skin. If it were, it might lead to copper poisoning.[163]
Compression clothing
Recently, some compression clothing with inter-woven copper has been marketed with health claims similar to the folk medicine claims. Because compression clothing is a valid treatment for some ailments, the clothing may have that benefit, but the added copper may have no benefit beyond a placebo effect.[164]
Degradation
Chromobacterium violaceum and Pseudomonas fluorescens can both mobilize solid copper as a cyanide compound.[165] The ericoid mycorrhizal fungi associated with Calluna, Erica and Vaccinium can grow in metalliferous soils containing copper.[165] The ectomycorrhizal fungus Suillus luteus protects young pine trees from copper toxicity. A sample of the fungus Aspergillus niger was found growing from gold mining solution and was found to contain cyano complexes of such metals as gold, silver, copper, iron, and zinc. The fungus also plays a role in the solubilization of heavy metal sulfides.[166]
Biological role
Rich sources of copper include oysters, beef and lamb liver, Brazil nuts, blackstrap molasses, cocoa, and black pepper. Good sources include lobster, nuts and sunflower seeds, green olives, avocados, and wheat bran.
Biochemistry
Copper proteins have diverse roles in biological electron transport and oxygen transportation, processes that exploit the easy interconversion of Cu(I) and Cu(II).[167] Copper is essential in the aerobic respiration of all eukaryotes. In mitochondria, it is found in cytochrome c oxidase, which is the last protein in oxidative phosphorylation. Cytochrome c oxidase is the protein that binds the O2 between a copper and an iron; the protein transfers 8 electrons to the O2 molecule to reduce it to two molecules of water. Copper is also found in many superoxide dismutases, proteins that catalyze the decomposition of superoxides by converting it (by disproportionation) to oxygen and hydrogen peroxide:
- Cu2+-SOD + O2− → Cu+-SOD + O2 (reduction of copper; oxidation of superoxide)
- Cu+-SOD + O2− + 2H+ → Cu2+-SOD + H2O2 (oxidation of copper; reduction of superoxide)
The protein hemocyanin is the oxygen carrier in most mollusks and some arthropods such as the horseshoe crab (Limulus polyphemus).[168] Because hemocyanin is blue, these organisms have blue blood rather than the red blood of iron-based hemoglobin. Structurally related to hemocyanin are the laccases and tyrosinases. Instead of reversibly binding oxygen, these proteins hydroxylate substrates, illustrated by their role in the formation of lacquers.[169] The biological role for copper commenced with the appearance of oxygen in earth’s atmosphere.[170] Several copper proteins, such as the «blue copper proteins», do not interact directly with substrates; hence they are not enzymes. These proteins relay electrons by the process called electron transfer.[169]
Photosynthesis functions by an elaborate electron transport chain within the thylakoid membrane. A central link in this chain is plastocyanin, a blue copper protein.
A unique tetranuclear copper center has been found in nitrous-oxide reductase.[171]
Chemical compounds which were developed for treatment of Wilson’s disease have been investigated for use in cancer therapy.[172]
Nutrition
Copper is an essential trace element in plants and animals, but not all microorganisms. The human body contains copper at a level of about 1.4 to 2.1 mg per kg of body mass.[173]
Absorption
Copper is absorbed in the gut, then transported to the liver bound to albumin.[174] After processing in the liver, copper is distributed to other tissues in a second phase, which involves the protein ceruloplasmin, carrying the majority of copper in blood. Ceruloplasmin also carries the copper that is excreted in milk, and is particularly well-absorbed as a copper source.[175] Copper in the body normally undergoes enterohepatic circulation (about 5 mg a day, vs. about 1 mg per day absorbed in the diet and excreted from the body), and the body is able to excrete some excess copper, if needed, via bile, which carries some copper out of the liver that is not then reabsorbed by the intestine.[176][177]
Dietary recommendations
The U.S. Institute of Medicine (IOM) updated the estimated average requirements (EARs) and recommended dietary allowances (RDAs) for copper in 2001. If there is not sufficient information to establish EARs and RDAs, an estimate designated Adequate Intake (AI) is used instead. The AIs for copper are: 200 μg of copper for 0–6-month-old males and females, and 220 μg of copper for 7–12-month-old males and females. For both sexes, the RDAs for copper are: 340 μg of copper for 1–3 years old, 440 μg of copper for 4–8 years old, 700 μg of copper for 9–13 years old, 890 μg of copper for 14–18 years old and 900 μg of copper for ages 19 years and older. For pregnancy, 1,000 μg. For lactation, 1,300 μg.[178] As for safety, the IOM also sets tolerable upper intake levels (ULs) for vitamins and minerals when evidence is sufficient. In the case of copper the UL is set at 10 mg/day. Collectively the EARs, RDAs, AIs and ULs are referred to as Dietary Reference Intakes.[179]
The European Food Safety Authority (EFSA) refers to the collective set of information as Dietary Reference Values, with Population Reference Intake (PRI) instead of RDA, and Average Requirement instead of EAR. AI and UL defined the same as in United States. For women and men ages 18 and older the AIs are set at 1.3 and 1.6 mg/day, respectively. AIs for pregnancy and lactation is 1.5 mg/day. For children ages 1–17 years the AIs increase with age from 0.7 to 1.3 mg/day. These AIs are higher than the U.S. RDAs.[180] The European Food Safety Authority reviewed the same safety question and set its UL at 5 mg/day, which is half the U.S. value.[181]
For U.S. food and dietary supplement labeling purposes the amount in a serving is expressed as a percent of Daily Value (%DV). For copper labeling purposes 100% of the Daily Value was 2.0 mg, but as of May 27, 2016 it was revised to 0.9 mg to bring it into agreement with the RDA.[182][183] A table of the old and new adult daily values is provided at Reference Daily Intake.
Deficiency
Because of its role in facilitating iron uptake, copper deficiency can produce anemia-like symptoms, neutropenia, bone abnormalities, hypopigmentation, impaired growth, increased incidence of infections, osteoporosis, hyperthyroidism, and abnormalities in glucose and cholesterol metabolism. Conversely, Wilson’s disease causes an accumulation of copper in body tissues.
Severe deficiency can be found by testing for low plasma or serum copper levels, low ceruloplasmin, and low red blood cell superoxide dismutase levels; these are not sensitive to marginal copper status. The «cytochrome c oxidase activity of leucocytes and platelets» has been stated as another factor in deficiency, but the results have not been confirmed by replication.[184]
Toxicity
Gram quantities of various copper salts have been taken in suicide attempts and produced acute copper toxicity in humans, possibly due to redox cycling and the generation of reactive oxygen species that damage DNA.[185][186] Corresponding amounts of copper salts (30 mg/kg) are toxic in animals.[187] A minimum dietary value for healthy growth in rabbits has been reported to be at least 3 ppm in the diet.[188] However, higher concentrations of copper (100 ppm, 200 ppm, or 500 ppm) in the diet of rabbits may favorably influence feed conversion efficiency, growth rates, and carcass dressing percentages.[189]
Chronic copper toxicity does not normally occur in humans because of transport systems that regulate absorption and excretion. Autosomal recessive mutations in copper transport proteins can disable these systems, leading to Wilson’s disease with copper accumulation and cirrhosis of the liver in persons who have inherited two defective genes.[173]
Elevated copper levels have also been linked to worsening symptoms of Alzheimer’s disease.[190][191]
Human exposure
In the US, the Occupational Safety and Health Administration (OSHA) has designated a permissible exposure limit (PEL) for copper dust and fumes in the workplace as a time-weighted average (TWA) of 1 mg/m3.[192] The National Institute for Occupational Safety and Health (NIOSH) has set a recommended exposure limit (REL) of 1 mg/m3, time-weighted average. The IDLH (immediately dangerous to life and health) value is 100 mg/m3.[193]
Copper is a constituent of tobacco smoke.[194][195] The tobacco plant readily absorbs and accumulates heavy metals, such as copper from the surrounding soil into its leaves. These are readily absorbed into the user’s body following smoke inhalation.[196] The health implications are not clear.[197]
See also
- Copper in renewable energy
- Copper nanoparticle
- Erosion corrosion of copper water tubes
- Cold water pitting of copper tube
- List of countries by copper production
- Metal theft
- Operation Tremor
- Anaconda Copper
- Antofagasta PLC
- Codelco
- El Boleo mine
- Grasberg mine
References
- ^ «Standard Atomic Weights: Copper». CIAAW. 1969.
- ^ Moret, Marc-Etienne; Zhang, Limei; Peters, Jonas C. (2013). «A Polar Copper–Boron One-Electron σ-Bond». J. Am. Chem. Soc. 135 (10): 3792–3795. doi:10.1021/ja4006578. PMID 23418750.
- ^ Lide, D. R., ed. (2005). «Magnetic susceptibility of the elements and inorganic compounds». CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5. Archived from the original (PDF) on 3 March 2011.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Robert McHenry, ed. (1992). «Bronze». The New Encyclopædia Britannica. Vol. 3 (15 ed.). Chicago: Encyclopædia Britannica, Incorporated. p. 612. ISBN 978-0-85229-553-3. OCLC 25228234.
- ^ «Copper». Merriam-Webster Dictionary. 2018. Retrieved 22 August 2018.
- ^ Johnson, MD PhD, Larry E., ed. (2008). «Copper». Merck Manual Home Health Handbook. Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc. Archived from the original on 7 March 2016. Retrieved 7 April 2013.
- ^ «Copper in human health».
- ^ a b Trigg, George L.; Immergut, Edmund H. (1992). Encyclopedia of Applied Physics. Vol. 4: Combustion to Diamagnetism. VCH. pp. 267–272. ISBN 978-3-527-28126-8. Retrieved 2 May 2011.
- ^ Smith, William F. & Hashemi, Javad (2003). Foundations of Materials Science and Engineering. McGraw-Hill Professional. p. 223. ISBN 978-0-07-292194-6.
- ^ a b c Hammond, C. R. (2004). The Elements, in Handbook of Chemistry and Physics (81st ed.). CRC Press. ISBN 978-0-8493-0485-9.
- ^ Resistance Welding Manufacturing Alliance (2003). Resistance Welding Manual (4th ed.). Resistance Welding Manufacturing Alliance. pp. 18–12. ISBN 978-0-9624382-0-2.
- ^ Chambers, William; Chambers, Robert (1884). Chambers’s Information for the People. Vol. L (5th ed.). W. & R. Chambers. p. 312. ISBN 978-0-665-46912-1.
- ^ Ramachandran, Harishankar (14 March 2007). «Why is Copper Red?» (PDF). IIT Madras. Retrieved 27 December 2022.
- ^ «Galvanic Corrosion». Corrosion Doctors. Retrieved 29 April 2011.
- ^ a b Grieken, Rene van; Janssens, Koen (2005). Cultural Heritage Conservation and Environmental Impact Assessment by Non-Destructive Testing and Micro-Analysis. CRC Press. p. 197. ISBN 978-0-203-97078-2.
- ^ «Copper.org: Education: Statue of Liberty: Reclothing the First Lady of Metals – Repair Concerns». Copper.org. Retrieved 11 April 2011.
- ^ Rickett, B. I.; Payer, J. H. (1995). «Composition of Copper Tarnish Products Formed in Moist Air with Trace Levels of Pollutant Gas: Hydrogen Sulfide and Sulfur Dioxide/Hydrogen Sulfide». Journal of the Electrochemical Society. 142 (11): 3723–3728. Bibcode:1995JElS..142.3723R. doi:10.1149/1.2048404.
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ «Interactive Chart of Nuclides». National Nuclear Data Center. Archived from the original on 25 August 2013. Retrieved 8 April 2011.
- ^ Okazawad, Hidehiko; Yonekura, Yoshiharu; Fujibayashi, Yasuhisa; Nishizawa, Sadahiko; Magata, Yasuhiro; Ishizu, Koichi; Tanaka, Fumiko; Tsuchida, Tatsuro; Tamaki, Nagara; Konishi, Junji (1994). «Clinical Application and Quantitative Evaluation of Generator-Produced Copper-62-PTSM as a Brain Perfusion Tracer for PET» (PDF). Journal of Nuclear Medicine. 35 (12): 1910–1915. PMID 7989968.
- ^ Romano, Donatella; Matteucci, Fransesca (2007). «Contrasting copper evolution in ω Centauri and the Milky Way». Monthly Notices of the Royal Astronomical Society: Letters. 378 (1): L59–L63. arXiv:astro-ph/0703760. Bibcode:2007MNRAS.378L..59R. doi:10.1111/j.1745-3933.2007.00320.x. S2CID 14595800.
- ^ a b c d Emsley, John (2003). Nature’s building blocks: an A–Z guide to the elements. Oxford University Press. pp. 121–125. ISBN 978-0-19-850340-8. Retrieved 2 May 2011.
- ^ Rickwood, P. C. (1981). «The largest crystals» (PDF). American Mineralogist. 66: 885.
- ^ Emsley, John (2003). Nature’s building blocks: an A–Z guide to the elements. Oxford University Press. pp. 124, 231, 449, 503. ISBN 978-0-19-850340-8. Retrieved 2 May 2011.
- ^ Rieuwerts, John (2015). The Elements of Environmental Pollution. London and New York: Earthscan Routledge. p. 207. ISBN 978-0-415-85919-6. OCLC 886492996.
- ^ Randazzo, Ryan (19 June 2011). «A new method to harvest copper». Azcentral.com. Retrieved 25 April 2014.
- ^ Gordon, R.B.; Bertram, M.; Graedel, T.E. (2006). «Metal stocks and sustainability». Proceedings of the National Academy of Sciences. 103 (5): 1209–1214. Bibcode:2006PNAS..103.1209G. doi:10.1073/pnas.0509498103. PMC 1360560. PMID 16432205.
- ^ Beaudoin, Yannick C.; Baker, Elaine (December 2013). Deep Sea Minerals: Manganese Nodules, a physical, biological, environmental and technical review. Secretariat of the Pacific Community. pp. 7–18. ISBN 978-82-7701-119-6. Retrieved 8 February 2021.
- ^ a b Leonard, Andrew (3 March 2006). «Peak copper?». Salon. Retrieved 8 March 2022.
- ^ Brown, Lester (2006). Plan B 2.0: Rescuing a Planet Under Stress and a Civilization in Trouble. New York: W.W. Norton. p. 109. ISBN 978-0-393-32831-8.
- ^ Schmitz, Christopher (1986). «The Rise of Big Business in the World, Copper Industry 1870–1930». Economic History Review. 2. 39 (3): 392–410. doi:10.1111/j.1468-0289.1986.tb00411.x. JSTOR 2596347.
- ^ «Copper Trends: Live Metal Spot Prices». Archived from the original on 1 May 2012.
- ^ Ackerman, R. (2 April 2009). «A Bottom in Sight For Copper». Forbes. Archived from the original on 8 December 2012.
- ^ Employment Appeal Tribunal, AEI Cables Ltd. v GMB and others, 5 April 2013, accessed 5 February 2021
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Su, Kun; Ma, Xiaodong; Parianos, John; Zhao, Baojun (2020). «Thermodynamic and Experimental Study on Efficient Extraction of Valuable Metals from Polymetallic Nodules». Minerals. 10 (4): 360. Bibcode:2020Mine…10..360S. doi:10.3390/min10040360.
- ^ International Seabed Authority. «Polymetallic Nodules» (PDF). International Seabed Authority. Retrieved 8 February 2021.
- ^ Watling, H.R. (2006). «The bioleaching of sulphide minerals with emphasis on copper sulphides – A review» (PDF). Hydrometallurgy. 84 (1): 81–108. doi:10.1016/j.hydromet.2006.05.001. Archived from the original (PDF) on 18 August 2011.
- ^ Samans, Carl (1949). Engineering metals and their alloys. New York: Macmillan. OCLC 716492542.
- ^ Burton, Julie McCulloch (2015). Pen to Paper: Making Fun of Life. iUniverse. ISBN 978-1-4917-5394-1.
- ^ Bahadir, Ali Mufit; Duca, Gheorghe (2009). The Role of Ecological Chemistry in Pollution Research and Sustainable Development. Springer. ISBN 978-90-481-2903-4.
- ^ Green, Dan (2016). The Periodic Table in Minutes. Quercus. ISBN 978-1-68144-329-4.
- ^ «International Copper Association». Archived from the original on 5 March 2012. Retrieved 22 July 2009.
- ^ «Overview of Recycled Copper» Copper.org. (25 August 2010). Retrieved on 8 November 2011.
- ^ «Dime». US Mint. Retrieved 9 July 2019.[permanent dead link]
- ^ «Pride and skill – the 10-cent coin». Royal Canadian Mint. Retrieved 9 July 2019.
- ^ «Gold Jewellery Alloys». World Gold Council. Archived from the original on 14 April 2009. Retrieved 6 June 2009.
- ^ Balver Zinn Solder Sn97Cu3 Archived 7 July 2011 at the Wayback Machine. (PDF) . balverzinn.com. Retrieved on 8 November 2011.
- ^ Deane, D. V. «Modern Coinage Systems» (PDF). British Numismatic Society. Retrieved 1 July 2019.
- ^ «What is 90% Silver?». American Precious Metals Exchange (APMEX). Archived from the original on 28 July 2020. Retrieved 1 July 2019.
- ^ Corrosion Tests and Standards. ASTM International. 2005. p. 368.
- ^ Oguchi, Hachiro (1983). «Japanese Shakudō: its history, properties and production from gold-containing alloys». Gold Bulletin. 16 (4): 125–132. doi:10.1007/BF03214636.
- ^ a b c Holleman, A.F.; Wiberg, N. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ Trammell, Rachel; Rajabimoghadam, Khashayar; Garcia-Bosch, Isaac (30 January 2019). «Copper-Promoted Functionalization of Organic Molecules: from Biologically Relevant Cu/O2 Model Systems to Organometallic Transformations». Chemical Reviews. 119 (4): 2954–3031. doi:10.1021/acs.chemrev.8b00368. PMC 6571019. PMID 30698952.
- ^ a b Wiley-Vch (2 April 2007). «Nonsystematic (Contact) Fungicides». Ullmann’s Agrochemicals. p. 623. ISBN 978-3-527-31604-5.
- ^ Ralph L. Shriner, Christine K.F. Hermann, Terence C. Morrill, David Y. Curtin, Reynold C. Fuson «The Systematic Identification of Organic Compounds» 8th edition, J. Wiley, Hoboken. ISBN 0-471-21503-1
- ^ Saalwächter, Kay; Burchard, Walther; Klüfers, Peter; Kettenbach, G.; Mayer, Peter; Klemm, Dieter; Dugarmaa, Saran (2000). «Cellulose Solutions in Water Containing Metal Complexes». Macromolecules. 33 (11): 4094–4107. Bibcode:2000MaMol..33.4094S. CiteSeerX 10.1.1.951.5219. doi:10.1021/ma991893m.
- ^ Deodhar, S., Huckaby, J., Delahoussaye, M. and DeCoster, M.A., 2014, August. High-aspect ratio bio-metallic nanocomposites for cellular interactions. In IOP Conference Series: Materials Science and Engineering (Vol. 64, No. 1, p. 012014). https://iopscience.iop.org/article/10.1088/1757-899X/64/1/012014/meta.
- ^ Kelly, K.C., Wasserman, J.R., Deodhar, S., Huckaby, J. and DeCoster, M.A., 2015. Generation of scalable, metallic high-aspect ratio nanocomposites in a biological liquid medium. JoVE (Journal of Visualized Experiments), (101), p.e52901. https://www.jove.com/t/52901/generation-scalable-metallic-high-aspect-ratio-nanocomposites.
- ^ Karan, A., Darder, M., Kansakar, U., Norcross, Z. and DeCoster, M.A., 2018. Integration of a Copper-Containing Biohybrid (CuHARS) with Cellulose for Subsequent Degradation and Biomedical Control. International journal of environmental research and public health, 15(5), p.844. https://www.mdpi.com/1660-4601/15/5/844
- ^ «Modern Organocopper Chemistry» Norbert Krause, Ed., Wiley-VCH, Weinheim, 2002. ISBN 978-3-527-29773-3.
- ^ Berná, José; Goldup, Stephen; Lee, Ai-Lan; Leigh, David; Symes, Mark; Teobaldi, Gilberto; Zerbetto, Fransesco (26 May 2008). «Cadiot–Chodkiewicz Active Template Synthesis of Rotaxanes and Switchable Molecular Shuttles with Weak Intercomponent Interactions». Angewandte Chemie. 120 (23): 4464–4468. Bibcode:2008AngCh.120.4464B. doi:10.1002/ange.200800891.
- ^ Rafael Chinchilla & Carmen Nájera (2007). «The Sonogashira Reaction: A Booming Methodology in Synthetic Organic Chemistry». Chemical Reviews. 107 (3): 874–922. doi:10.1021/cr050992x. PMID 17305399.
- ^ «An Addition of an Ethylcopper Complex to 1-Octyne: (E)-5-Ethyl-1,4-Undecadiene» (PDF). Organic Syntheses. 64: 1. 1986. doi:10.15227/orgsyn.064.0001. Archived from the original (PDF) on 19 June 2012.
- ^ Kharasch, M.S.; Tawney, P.O. (1941). «Factors Determining the Course and Mechanisms of Grignard Reactions. II. The Effect of Metallic Compounds on the Reaction between Isophorone and Methylmagnesium Bromide». Journal of the American Chemical Society. 63 (9): 2308–2316. doi:10.1021/ja01854a005.
- ^ Imai, Sadako; Fujisawa, Kiyoshi; Kobayashi, Takako; Shirasawa, Nobuhiko; Fujii, Hiroshi; Yoshimura, Tetsuhiko; Kitajima, Nobumasa; Moro-oka, Yoshihiko (1998). «63Cu NMR Study of Copper(I) Carbonyl Complexes with Various Hydrotris(pyrazolyl)borates: Correlation between 63Cu Chemical Shifts and CO Stretching Vibrations». Inorganic Chemistry. 37 (12): 3066–3070. doi:10.1021/ic970138r.
- ^ G. Brauer, ed. (1963). «Potassium Cuprate (III)». Handbook of Preparative Inorganic Chemistry. Vol. 1 (2nd ed.). NY: Academic Press. p. 1015.
- ^ Schwesinger, Reinhard; Link, Reinhard; Wenzl, Peter; Kossek, Sebastian (2006). «Anhydrous phosphazenium fluorides as sources for extremely reactive fluoride ions in solution». Chemistry: A European Journal. 12 (2): 438–45. doi:10.1002/chem.200500838. PMID 16196062.
- ^ Lewis, E.A.; Tolman, W.B. (2004). «Reactivity of Dioxygen-Copper Systems». Chemical Reviews. 104 (2): 1047–1076. doi:10.1021/cr020633r. PMID 14871149.
- ^ McDonald, M.R.; Fredericks, F.C.; Margerum, D.W. (1997). «Characterization of Copper(III)–Tetrapeptide Complexes with Histidine as the Third Residue». Inorganic Chemistry. 36 (14): 3119–3124. doi:10.1021/ic9608713. PMID 11669966.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 1187. ISBN 978-0-08-037941-8.
- ^ A Timeline of Copper Technologies, Copper Development Association, https://www.copper.org/education/history/timeline/
- ^ a b «CSA – Discovery Guides, A Brief History of Copper». Csa.com. Archived from the original on 3 February 2015. Retrieved 12 September 2008.
- ^ Rayner W. Hesse (2007). Jewelrymaking through History: an Encyclopedia. Greenwood Publishing Group. p. 56. ISBN 978-0-313-33507-5.No primary source is given in that book.
- ^ «Copper». Elements.vanderkrogt.net. Retrieved 12 September 2008.
- ^ Renfrew, Colin (1990). Before civilization: the radiocarbon revolution and prehistoric Europe. Penguin. ISBN 978-0-14-013642-5. Retrieved 21 December 2011.
- ^ Cowen, R. «Essays on Geology, History, and People: Chapter 3: Fire and Metals». Retrieved 7 July 2009.
- ^ Timberlake, S. & Prag A.J.N.W. (2005). The Archaeology of Alderley Edge: Survey, excavation and experiment in an ancient mining landscape. Oxford: John and Erica Hedges Ltd. p. 396. doi:10.30861/9781841717159. ISBN 9781841717159.
- ^ a b «CSA – Discovery Guides, A Brief History of Copper». CSA Discovery Guides. Archived from the original on 3 February 2015. Retrieved 29 April 2011.
- ^ Pleger, Thomas C. «A Brief Introduction to the Old Copper Complex of the Western Great Lakes: 4000–1000 BC», Proceedings of the Twenty-Seventh Annual Meeting of the Forest History Association of Wisconsin, Oconto, Wisconsin, 5 October 2002, pp. 10–18.
- ^ Emerson, Thomas E. and McElrath, Dale L. Archaic Societies: Diversity and Complexity Across the Midcontinent, SUNY Press, 2009 ISBN 1-4384-2701-8.
- ^ Dainian, Fan. Chinese Studies in the History and Philosophy of Science and Technology. p. 228.
- ^ Wallach, Joel. Epigenetics: The Death of the Genetic Theory of Disease Transmission.
- ^ Radivojević, Miljana; Rehren, Thilo (December 2013). «Tainted ores and the rise of tin bronzes in Eurasia, c. 6500 years ago». Antiquity Publications Ltd.
- ^ a b McNeil, Ian (2002). Encyclopaedia of the History of Technology. London; New York: Routledge. pp. 13, 48–66. ISBN 978-0-203-19211-5.
- ^ Rickard, T.A. (1932). «The Nomenclature of Copper and its Alloys». Journal of the Royal Anthropological Institute. 62: 281–290. doi:10.2307/2843960. JSTOR 2843960.
- ^ Timberlake, Simon (11 June 2017). «New ideas on the exploitation of copper, tin, gold, and lead ores in Bronze Age Britain: The mining, smelting, and movement of metal». Materials and Manufacturing Processes. 32 (7–8): 709–727. doi:10.1080/10426914.2016.1221113. S2CID 138178474.
- ^ Martin, Susan R. (1995). «The State of Our Knowledge About Ancient Copper Mining in Michigan». The Michigan Archaeologist. 41 (2–3): 119. Archived from the original on 7 February 2016.
- ^ Hong, S.; Candelone, J.-P.; Patterson, C.C.; Boutron, C.F. (1996). «History of Ancient Copper Smelting Pollution During Roman and Medieval Times Recorded in Greenland Ice». Science. 272 (5259): 246–249 (247f.). Bibcode:1996Sci…272..246H. doi:10.1126/science.272.5259.246. S2CID 176767223.
- ^ de Callataÿ, François (2005). «The Graeco-Roman Economy in the Super Long-Run: Lead, Copper, and Shipwrecks». Journal of Roman Archaeology. 18: 361–372 (366–369). doi:10.1017/S104775940000742X. S2CID 232346123.
- ^ Savenije, Tom J.; Warman, John M.; Barentsen, Helma M.; van Dijk, Marinus; Zuilhof, Han; Sudhölter, Ernst J.R. (2000). «Corinthian Bronze and the Gold of the Alchemists» (PDF). Macromolecules. 33 (2): 60–66. Bibcode:2000MaMol..33…60S. doi:10.1021/ma9904870. Archived from the original (PDF) on 29 September 2007.
- ^ Lynch, Martin (2004). Mining in World History. p. 60. ISBN 978-1-86189-173-0.
- ^ «Gold: prices, facts, figures and research: A brief history of money». Retrieved 22 April 2011.
- ^ «Copper and Brass in Ships». Retrieved 6 September 2016.
- ^ Stelter, M.; Bombach, H. (2004). «Process Optimization in Copper Electrorefining». Advanced Engineering Materials. 6 (7): 558–562. doi:10.1002/adem.200400403. S2CID 138550311.
- ^ Gardner, E. D.; et al. (1938). Copper Mining in North America. Washington, D. C.: U. S. Bureau of Mines. Retrieved 19 March 2019.
- ^ Hyde, Charles (1998). Copper for America, the United States Copper Industry from Colonial Times to the 1990s. Tucson, Arizona: University of Arizona Press. p. passim. ISBN 0-8165-1817-3.
- ^ «Outokumpu Flash Smelting» (PDF). Outokumpu. p. 2. Archived from the original (PDF) on 24 July 2011.
- ^ Karen A. Mingst (1976). «Cooperation or illusion: an examination of the intergovernmental council of copper exporting countries». International Organization. 30 (2): 263–287. doi:10.1017/S0020818300018270. S2CID 154183817.
- ^ Ryck Lydecker. «Is Copper Bottom Paint Sinking?». BoatUS Magazine. Retrieved 3 June 2016.
- ^ «Copper». American Elements. 2008. Archived from the original on 8 June 2008. Retrieved 12 July 2008.
- ^ Pops, Horace, 2008, «Processing of wire from antiquity to the future», Wire Journal International, June, pp. 58–66
- ^ The Metallurgy of Copper Wire, http://www.litz-wire.com/pdf%20files/Metallurgy_Copper_Wire.pdf Archived 1 September 2013 at the Wayback Machine
- ^ Joseph, Günter, 1999, Copper: Its Trade, Manufacture, Use, and Environmental Status, edited by Kundig, Konrad J.A., ASM International, pp. 141–192 and pp. 331–375.
- ^ «Copper, Chemical Element – Overview, Discovery and naming, Physical properties, Chemical properties, Occurrence in nature, Isotopes». Chemistryexplained.com. Retrieved 16 October 2012.
- ^ Joseph, Günter, 1999, Copper: Its Trade, Manufacture, Use, and Environmental Status, edited by Kundig, Konrad J.A., ASM International, p.348
- ^ «Aluminum Wiring Hazards and Pre-Purchase Inspections». www.heimer.com. Archived from the original on 28 May 2016. Retrieved 3 June 2016.
- ^ «Accelerator: Waveguides (SLAC VVC)». SLAC Virtual Visitor Center. Retrieved 29 April 2011.
- ^ IE3 energy-saving motors, Engineer Live, http://www.engineerlive.com/Design-Engineer/Motors_and_Drives/IE3_energy-saving_motors/22687/
- ^ Energy‐efficiency policy opportunities for electric motor‐driven systems, International Energy Agency, 2011 Working Paper in the Energy Efficiency Series, by Paul Waide and Conrad U. Brunner, OECD/IEA 2011
- ^ Fuchsloch, J. and E.F. Brush, (2007), «Systematic Design Approach for a New Series of Ultra‐NEMA Premium Copper Rotor Motors», in EEMODS 2007 Conference Proceedings, 10–15 June, Beijing.
- ^ Copper motor rotor project; Copper Development Association; «Copper.org: Copper Motor Rotor Project». Archived from the original on 13 March 2012. Retrieved 7 November 2012.
- ^ NEMA Premium Motors, The Association of Electrical Equipment and Medical Imaging Manufacturers; «NEMA — NEMA Premium Motors». Archived from the original on 2 April 2010. Retrieved 12 October 2009.
- ^ International Energy Agency, IEA sees renewable energy growth accelerating over next 5 years, http://www.iea.org/newsroomandevents/pressreleases/2012/july/name,28200,en.html
- ^ Global trends in renewable energy investment 2012, by REN21 (Renewable Energy Policy Network for the 21st Century); http://www.ren21.net/gsr
- ^ Will the Transition to Renewable Energy Be Paved in Copper?, Renewable Energy World; Jan 15, 2016; https://www.renewableenergyworld.com/articles/2016/01/will-the-transition-to-renewable-energy-be-paved-in-copper.html Archived 2018-06-22 at the Wayback Machine
- ^ García-Olivares, Antonio, Joaquim Ballabrera-Poy, Emili García-Ladona, and Antonio Turiel. A global renewable mix with proven technologies and common materials, Energy Policy, 41 (2012): 561-57, http://imedea.uib-csic.es/master/cambioglobal/Modulo_I_cod101601/Ballabrera_Diciembre_2011/Articulos/Garcia-Olivares.2011.pdf
- ^ A kilo more of copper increases environmental performance by 100 to 1,000 times; Renewable Energy Magazine; April 14, 2011; http://www.renewableenergymagazine.com/article/a-kilo-more-of-copper-increases-environmental
- ^ Copper at the core of renewable energies; European Copper Institute; European Copper Institute; 18 pages; http://www.eurocopper.org/files/presskit/press_kit_copper_in_renewables_final_29_10_2008.pdf Archived 2012-05-23 at the Wayback Machine
- ^ Copper in energy systems; Copper Development Association Inc.; http://www.copper.org/environment/green/energy.html
- ^ The Rise Of Solar: A Unique Opportunity For Copper; Solar Industry Magazine; April 2017; Zolaika Strong; https://issues.solarindustrymag.com/article/rise-solar-unique-opportunity-copper
- ^ Pops, Horace, 1995. Physical Metallurgy of Electrical Conductors, in Nonferrous Wire Handbook, Volume 3: Principles and Practice, The Wire Association International
- ^ The World Copper Factbook, 2017; http://www.icsg.org/index.php/component/jdownloads/finish/170/2462
- ^ Copper Mineral Commodity Summary (USGS, 2017) https://minerals.usgs.gov/minerals/pubs/commodity/copper/ mcs-2017-coppe.pdf
- ^ Global Mineral Resource Assessment (USGS, 2014) http://pubs.usgs.gov/fs/2014/3004/pdf/fs2014-3004.pdf
- ^ Long-Term Availability of Copper; International Copper Association; http://copperalliance.org/wordpress/wp-content/uploads/2018/02/ICA-long-term-availability-201802-A4-HR.pdf Archived 2018-06-29 at the Wayback Machine
- ^ Will the Transition to Renewable Energy Be Paved in Copper?, Renewable Energy World; Jan 15, 2016; by Zolaikha Strong; https://www.renewableenergyworld.com/articles/2016/01/will-the-transition-to-renewable-energy-be-paved-in-copper.html Archived 2018-06-22 at the Wayback Machine
- ^ Seale, Wayne (2007). The role of copper, brass, and bronze in architecture and design; Metal Architecture, May 2007
- ^ Copper roofing in detail; Copper in Architecture; Copper Development Association, U.K., www.cda.org.uk/arch
- ^ Architecture, European Copper Institute; http://eurocopper.org/copper/copper-architecture.html Archived 9 October 2012 at the Wayback Machine
- ^ Kronborg completed; Agency for Palaces and Cultural Properties, København, «Kronborg completed — Agency for Palaces and Cultural Properties». Archived from the original on 24 October 2012. Retrieved 12 September 2012.
- ^ Berg, Jan. «Why did we paint the library’s roof?». Archived from the original on 25 June 2007. Retrieved 20 September 2007.
- ^ Architectural considerations; Copper in Architecture Design Handbook, http://www.copper.org/applications/architecture/arch_dhb/fundamentals/arch_considerations.htm[permanent dead link]
- ^ Peters, Larry E. (2004). Preventing corrosion on copper roofing systems; Professional Roofing, October 2004, http://www.professionalroofing.net
- ^ Oxidation Reaction: Why is the Statue of Liberty Blue-Green? Engage Students in Engineering; www.EngageEngineering.org; Chun Wu, PhD, Mount Marty College; Funded by the National Science Foundation (NSF) under Grant No. 083306. «Archived copy» (PDF). Archived from the original (PDF) on 25 October 2013. Retrieved 25 October 2013.
{{cite web}}: CS1 maint: archived copy as title (link) - ^ Fitzgerald, K.P.; Nairn, J.; Atrens, A. (1998). «The chemistry of copper patination». Corrosion Science. 40 (12): 2029–50. doi:10.1016/S0010-938X(98)00093-6.
- ^ Application Areas: Architecture – Finishes – patina; http://www.copper.org/applications/architecture/finishes.html
- ^ Glossary of copper terms, Copper Development Association (UK): «Glossary of copper terms». Archived from the original on 20 August 2012. Retrieved 14 September 2012.
- ^ Finishes – natural weathering; Copper in Architecture Design Handbook, Copper Development Association Inc., «Copper.org: Architecture Design Handbook: Finishes». Archived from the original on 16 October 2012. Retrieved 12 September 2012.
- ^ Davis, Joseph R. (2001). Copper and Copper Alloys. ASM International. pp. 3–6, 266. ISBN 978-0-87170-726-0.
- ^ Edding, Mario E., Flores, Hector, and Miranda, Claudio, (1995), Experimental Usage of Copper-Nickel Alloy Mesh in Mariculture. Part 1: Feasibility of usage in a temperate zone; Part 2: Demonstration of usage in a cold zone; Final report to the International Copper Association Ltd.
- ^ Corrosion Behaviour of Copper Alloys used in Marine Aquaculture Archived 24 September 2013 at the Wayback Machine. (PDF) . copper.org. Retrieved on 8 November 2011.
- ^ Copper Touch Surfaces Archived 23 July 2012 at the Wayback Machine. Copper Touch Surfaces. Retrieved on 8 November 2011.
- ^ «EPA Registers Copper Surfaces for Residual Use Against Coronavirus». United States Environmental Protection Agency. 10 February 2021. Retrieved 11 October 2021.
- ^ Montero, David A.; Arellano, Carolina; Pardo, Mirka; Vera, Rosa; Gálvez, Ricardo; Cifuentes, Marcela; Berasain, María A.; Gómez, Marisol; Ramírez, Claudio; Vidal, Roberto M. (5 January 2019). «Antimicrobial properties of a novel copper-based composite coating with potential for use in healthcare facilities». Antimicrobial Resistance and Infection Control. 8 (1): 3. doi:10.1186/s13756-018-0456-4. ISSN 2047-2994. PMC 6321648. PMID 30627427.
- ^ a b «EPA registers copper-containing alloy products». United States Environmental Protection Agency. May 2008. Archived from the original on 29 September 2015.
- ^ Biurrun, Amaya; Caballero, Luis; Pelaz, Carmen; León, Elena; Gago, Alberto (1999). «Treatment of a Legionella pneumophila‐Colonized Water Distribution System Using Copper‐Silver Ionization and Continuous Chlorination» (PDF). Infection Control and Hospital Epidemiology. 20 (6): 426–428. doi:10.1086/501645. JSTOR 30141645. PMID 10395146. S2CID 32388649. Archived from the original (PDF) on 17 February 2019.
- ^ Zaleski, Andrew, As hospitals look to prevent infections, a chorus of researchers make a case for copper surfaces, STAT, 24 September 2020
- ^ Chilean subway protected with Antimicrobial Copper – Rail News from Archived 24 July 2012 at the Wayback Machine. rail.co. Retrieved on 8 November 2011.
- ^ Codelco to provide antimicrobial copper for new metro lines (Chile)[dead link]. Construpages.com.ve. Retrieved on 8 November 2011.
- ^ PR 811 Chilean Subway Installs Antimicrobial Copper Archived 23 November 2011 at the Wayback Machine. (PDF). antimicrobialcopper.com. Retrieved on 8 November 2011.
- ^ «Copper and Cupron». Cupron.
- ^ «Global copper market under supplied, demand on the rise – report». Mining.com. 6 January 2019. Retrieved 13 January 2019.
- ^ «Will the Transition to Renewable Energy Be Paved in Copper?». www.renewableenergyworld.com. 15 January 2015. Archived from the original on 22 June 2018. Retrieved 13 January 2019.
- ^ «Copper and cars: Boom goes beyond electric vehicles». MINING.com. 18 June 2018. Retrieved 13 January 2019.
- ^ «Impact of electric cars in medium-term copper demand ‘overrated’, experts say». MINING.com. 12 April 2018. Retrieved 13 January 2019.
- ^ «Why are Premiums for Copper Bullion So High?». Provident Metals. 20 August 2012. Retrieved 23 January 2019.
- ^ Chace, Zoe. «Penny Hoarders Hope for the Day The Penny Dies». NPR.org. NPR. Retrieved 23 January 2019.
- ^ Walker, W.R.; Keats, D.M. (1976). «An investigation of the therapeutic value of the ‘copper bracelet’-dermal assimilation of copper in arthritic/rheumatoid conditions». Agents and Actions. 6 (4): 454–459. PMID 961545.
- ^ Richmond SJ, Gunadasa S, Bland M, Macpherson H (2013). «Copper bracelets and magnetic wrist straps for rheumatoid arthritis – analgesic and anti-inflammatory effects: a randomised double-blind placebo controlled crossover trial». PLOS ONE. 8 (9): e71529. Bibcode:2013PLoSO…871529R. doi:10.1371/journal.pone.0071529. PMC 3774818. PMID 24066023.
- ^ Richmond, Stewart J.; Brown, Sally R.; Campion, Peter D.; Porter, Amanda J.L.; Moffett, Jennifer A. Klaber; Jackson, David A.; Featherstone, Valerie A.; Taylor, Andrew J. (2009). «Therapeutic effects of magnetic and copper bracelets in osteoarthritis: A randomised placebo-controlled crossover trial». Complementary Therapies in Medicine. 17 (5–6): 249–256. doi:10.1016/j.ctim.2009.07.002. ISSN 0965-2299. PMID 19942103.
- ^ University of Arkansas for Medical Sciences:
Find the Truth Behind Medical Myths Archived 6 January 2014 at the Wayback MachineWhile it’s never been proven that copper can be absorbed through the skin by wearing a bracelet, research has shown that excessive copper can result in poisoning, causing vomiting and, in severe cases, liver damage.
- ^
Truth in Advertising
Tommie Copper - ^ a b Geoffrey Michael Gadd (March 2010). «Metals, minerals and microbes: geomicrobiology and bioremediation». Microbiology. 156 (3): 609–643. doi:10.1099/mic.0.037143-0. PMID 20019082.
- ^ Harbhajan Singh (2006). Mycoremediation: Fungal Bioremediation. p. 509. ISBN 978-0-470-05058-3.
- ^ Vest, Katherine E.; Hashemi, Hayaa F.; Cobine, Paul A. (2013). «Chapter 13 The Copper Metallome in Eukaryotic Cells». In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 451–78. doi:10.1007/978-94-007-5561-1_13. ISBN 978-94-007-5560-4. PMID 23595680. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402
- ^ «Fun facts». Horseshoe crab. University of Delaware. Archived from the original on 22 October 2008. Retrieved 13 July 2008.
- ^ a b S.J. Lippard, J.M. Berg «Principles of bioinorganic chemistry» University Science Books: Mill Valley, CA; 1994. ISBN 0-935702-73-3.
- ^ Decker, H. & Terwilliger, N. (2000). «COPs and Robbers: Putative evolution of copper oxygen-binding proteins». Journal of Experimental Biology. 203 (Pt 12): 1777–1782. doi:10.1242/jeb.203.12.1777. PMID 10821735.
- ^
Schneider, Lisa K.; Wüst, Anja; Pomowski, Anja; Zhang, Lin; Einsle, Oliver (2014). «Chapter 8. No Laughing Matter: The Unmaking of the Greenhouse Gas Dinitrogen Monoxide by Nitrous Oxide Reductase«. In Peter M.H. Kroneck; Martha E. Sosa Torres (eds.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 177–210. doi:10.1007/978-94-017-9269-1_8. ISBN 978-94-017-9268-4. PMID 25416395. - ^ Denoyer, Delphine; Clatworthy, Sharnel A.S.; Cater, Michael A. (2018). «Chapter 16. Copper Complexes in Cancer Therapy». In Sigel, Astrid; Sigel, Helmut; Freisinger, Eva; Sigel, Roland K.O. (eds.). Metallo-Drugs: Development and Action of Anticancer Agents. Metal Ions in Life Sciences. Vol. 18. Berlin: de Gruyter GmbH. pp. 469–506. doi:10.1515/9783110470734-022. ISBN 978-3-11-047073-4. PMID 29394035.
- ^ a b «Amount of copper in the normal human body, and other nutritional copper facts». Archived from the original on 10 April 2009. Retrieved 3 April 2009.
- ^ Adelstein, S. J.; Vallee, B. L. (1961). «Copper metabolism in man». New England Journal of Medicine. 265 (18): 892–897. doi:10.1056/NEJM196111022651806. PMID 13859394.
- ^ M.C. Linder; Wooten, L.; Cerveza, P.; Cotton, S.; Shulze, R.; Lomeli, N. (1 May 1998). «Copper transport». The American Journal of Clinical Nutrition. 67 (5): 965S–971S. doi:10.1093/ajcn/67.5.965S. PMID 9587137.
- ^ Frieden, E.; Hsieh, H.S. (1976). Ceruloplasmin: The copper transport protein with essential oxidase activity. Advances in Enzymology – and Related Areas of Molecular Biology. Vol. 44. pp. 187–236. doi:10.1002/9780470122891.ch6. ISBN 978-0-470-12289-1. JSTOR 20170553. PMID 775938.
- ^ S.S. Percival; Harris, E.D. (1 January 1990). «Copper transport from ceruloplasmin: Characterization of the cellular uptake mechanism». American Journal of Physiology. Cell Physiology. 258 (1): C140–C146. doi:10.1152/ajpcell.1990.258.1.c140. PMID 2301561.
- ^ Dietary Reference Intakes: RDA and AI for Vitamins and Elements Archived 13 November 2018 at the Wayback Machine Food and Nutrition Board, Institute of Medicine, National Academies Press, 2011. Retrieved 18 April 2018.
- ^ Copper. IN: Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Copper. National Academy Press. 2001, PP. 224–257.
- ^ «Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies» (PDF). 2017.
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006
- ^ «Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR p. 33982» (PDF).
- ^ «Daily Value Reference of the Dietary Supplement Label Database (DSLD)». Dietary Supplement Label Database (DSLD). Archived from the original on 7 April 2020. Retrieved 16 May 2020.
- ^ Bonham, Maxine; O’Connor, Jacqueline M.; Hannigan, Bernadette M.; Strain, J.J. (2002). «The immune system as a physiological indicator of marginal copper status?». British Journal of Nutrition. 87 (5): 393–403. doi:10.1079/BJN2002558. PMID 12010579.
- ^ Li, Yunbo; Trush, Michael; Yager, James (1994). «DNA damage caused by reactive oxygen species originating from a copper-dependent oxidation of the 2-hydroxy catechol of estradiol». Carcinogenesis. 15 (7): 1421–1427. doi:10.1093/carcin/15.7.1421. PMID 8033320.
- ^ Gordon, Starkebaum; John, M. Harlan (April 1986). «Endothelial cell injury due to copper-catalyzed hydrogen peroxide generation from homocysteine». J. Clin. Invest. 77 (4): 1370–6. doi:10.1172/JCI112442. PMC 424498. PMID 3514679.
- ^ «Pesticide Information Profile for Copper Sulfate». Cornell University. Retrieved 10 July 2008.
- ^ Hunt, Charles E. & William W. Carlton (1965). «Cardiovascular Lesions Associated with Experimental Copper Deficiency in the Rabbit». Journal of Nutrition. 87 (4): 385–394. doi:10.1093/jn/87.4.385. PMID 5841854.
- ^ Ayyat M.S.; Marai I.F.M.; Alazab A.M. (1995). «Copper-Protein Nutrition of New Zealand White Rabbits under Egyptian Conditions». World Rabbit Science. 3 (3): 113–118. doi:10.4995/wrs.1995.249.
- ^ Brewer GJ (March 2012). «Copper excess, zinc deficiency, and cognition loss in Alzheimer’s disease». BioFactors (Review). 38 (2): 107–113. doi:10.1002/biof.1005. hdl:2027.42/90519. PMID 22438177. S2CID 16989047.
- ^ «Copper: Alzheimer’s Disease». Examine.com. Retrieved 21 June 2015.
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0151». National Institute for Occupational Safety and Health (NIOSH).
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0150». National Institute for Occupational Safety and Health (NIOSH).
- ^ OEHHA Copper
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). «Hazardous Compounds in Tobacco Smoke». International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207.
- ^ Pourkhabbaz, A.; Pourkhabbaz, H. (2012). «Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues». Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865. PMID 23493960.
- ^ Bernhard, David; Rossmann, Andrea; Wick, Georg (2005). «Metals in cigarette smoke». IUBMB Life. 57 (12): 805–809. doi:10.1080/15216540500459667. PMID 16393783. S2CID 35694266.
Notes
|
|
|
|
|
| in pure water, or acidic or alkali conditions. Copper in neutral water is more noble than hydrogen. | in water containing sulfide | in 10 M ammonia solution | in a chloride solution |
Further reading
- Massaro, Edward J., ed. (2002). Handbook of Copper Pharmacology and Toxicology. Humana Press. ISBN 978-0-89603-943-8.
- «Copper: Technology & Competitiveness (Summary) Chapter 6: Copper Production Technology» (PDF). Office of Technology Assessment. 2005.
- Current Medicinal Chemistry, Volume 12, Number 10, May 2005, pp. 1161–1208(48) Metals, Toxicity and Oxidative Stress
- William D. Callister (2003). Materials Science and Engineering: an Introduction (6th ed.). Wiley, New York. Table 6.1, p. 137. ISBN 978-0-471-73696-7.
- Material: Copper (Cu), bulk, MEMS and Nanotechnology Clearinghouse.
- Kim BE; Nevitt T; Thiele DJ (2008). «Mechanisms for copper acquisition, distribution and regulation». Nat. Chem. Biol. 4 (3): 176–85. doi:10.1038/nchembio.72. PMID 18277979.
External links
Wikiquote has quotations related to Copper.
Wikimedia Commons has media related to Copper.
Look up copper in Wiktionary, the free dictionary.
Wikisource has original text related to this article:
- Copper at The Periodic Table of Videos (University of Nottingham)
- Copper and compounds fact sheet from the National Pollutant Inventory of Australia
- Copper.org – official website of the Copper Development Association with an extensive site of properties and uses of copper
- Price history of copper, according to the IMF
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Copper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | red-orange metallic luster | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Cu) |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Copper in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 29 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 11 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d10 4s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1357.77 K (1084.62 °C, 1984.32 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2835 K (2562 °C, 4643 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 8.96 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 8.02 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 13.26 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 300.4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 24.440 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −2, 0,[2] +1, +2, +3, +4 (a mildly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.90 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 128 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 132±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of copper |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | (annealed) 3810 m/s (at r.t.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 16.5 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 401 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 16.78 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −5.46×10−6 cm3/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 110–128 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 48 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 140 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 3.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hardness | 343–369 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 235–878 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-50-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Naming | after Cyprus, principal mining place in Roman era (Cyprium) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Middle East (9000 BC) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | «Cu»: from Latin cuprum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of copper
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Copper is a chemical element with the symbol Cu (from Latin: cuprum) and atomic number 29. It is a soft, malleable, and ductile metal with very high thermal and electrical conductivity. A freshly exposed surface of pure copper has a pinkish-orange color. Copper is used as a conductor of heat and electricity, as a building material, and as a constituent of various metal alloys, such as sterling silver used in jewelry, cupronickel used to make marine hardware and coins, and constantan used in strain gauges and thermocouples for temperature measurement.
Copper is one of the few metals that can occur in nature in a directly usable metallic form (native metals). This led to very early human use in several regions, from circa 8000 BC. Thousands of years later, it was the first metal to be smelted from sulfide ores, circa 5000 BC; the first metal to be cast into a shape in a mold, c. 4000 BC; and the first metal to be purposely alloyed with another metal, tin, to create bronze, c. 3500 BC.[5]
In the Roman era, copper was mined principally on Cyprus, the origin of the name of the metal, from aes cyprium (metal of Cyprus), later corrupted to cuprum (Latin). Coper (Old English) and copper were derived from this, the later spelling first used around 1530.[6]
Commonly encountered compounds are copper(II) salts, which often impart blue or green colors to such minerals as azurite, malachite, and turquoise, and have been used widely and historically as pigments.
Copper used in buildings, usually for roofing, oxidizes to form a green verdigris (or patina). Copper is sometimes used in decorative art, both in its elemental metal form and in compounds as pigments. Copper compounds are used as bacteriostatic agents, fungicides, and wood preservatives.
Copper is essential to all living organisms as a trace dietary mineral because it is a key constituent of the respiratory enzyme complex cytochrome c oxidase. In molluscs and crustaceans, copper is a constituent of the blood pigment hemocyanin, replaced by the iron-complexed hemoglobin in fish and other vertebrates. In humans, copper is found mainly in the liver, muscle, and bone.[7] The adult body contains between 1.4 and 2.1 mg of copper per kilogram of body weight.[8]
Characteristics
Physical
Copper just above its melting point keeps its pink luster color when enough light outshines the orange incandescence color
Copper, silver, and gold are in group 11 of the periodic table; these three metals have one s-orbital electron on top of a filled d-electron shell and are characterized by high ductility, and electrical and thermal conductivity. The filled d-shells in these elements contribute little to interatomic interactions, which are dominated by the s-electrons through metallic bonds. Unlike metals with incomplete d-shells, metallic bonds in copper are lacking a covalent character and are relatively weak. This observation explains the low hardness and high ductility of single crystals of copper.[9] At the macroscopic scale, introduction of extended defects to the crystal lattice, such as grain boundaries, hinders flow of the material under applied stress, thereby increasing its hardness. For this reason, copper is usually supplied in a fine-grained polycrystalline form, which has greater strength than monocrystalline forms.[10]
The softness of copper partly explains its high electrical conductivity (59.6×106 S/m) and high thermal conductivity, second highest (second only to silver) among pure metals at room temperature.[11] This is because the resistivity to electron transport in metals at room temperature originates primarily from scattering of electrons on thermal vibrations of the lattice, which are relatively weak in a soft metal.[9] The maximum permissible current density of copper in open air is approximately 3.1×106 A/m2 of cross-sectional area, above which it begins to heat excessively.[12]
Copper is one of a few metallic elements with a natural color other than gray or silver.[13] Pure copper is orange-red and acquires a reddish tarnish when exposed to air. The is due to the low plasma frequency of the metal, which lies in the red part of the visible spectrum, causing it to absorb the higher-frequency green and blue colors.[14]
As with other metals, if copper is put in contact with another metal, galvanic corrosion will occur.[15]
Chemical
Unoxidized copper wire (left) and oxidized copper wire (right)
The East Tower of the Royal Observatory, Edinburgh, showing the contrast between the refurbished copper installed in 2010 and the green color of the original 1894 copper.
Copper does not react with water, but it does slowly react with atmospheric oxygen to form a layer of brown-black copper oxide which, unlike the rust that forms on iron in moist air, protects the underlying metal from further corrosion (passivation). A green layer of verdigris (copper carbonate) can often be seen on old copper structures, such as the roofing of many older buildings[16] and the Statue of Liberty.[17] Copper tarnishes when exposed to some sulfur compounds, with which it reacts to form various copper sulfides.[18]
Isotopes
There are 29 isotopes of copper. 63
Cu
and 65
Cu
are stable, with 63
Cu
comprising approximately 69% of naturally occurring copper; both have a spin of 3⁄2.[19] The other isotopes are radioactive, with the most stable being 67
Cu
with a half-life of 61.83 hours.[19] Seven metastable isotopes have been characterized; 68m
Cu
is the longest-lived with a half-life of 3.8 minutes. Isotopes with a mass number above 64 decay by β−, whereas those with a mass number below 64 decay by β+. 64
Cu
, which has a half-life of 12.7 hours, decays both ways.[20]
62
Cu
and 64
Cu
have significant applications. 62
Cu
is used in 62
Cu
Cu-PTSM as a radioactive tracer for positron emission tomography.[21]
Occurrence
Native copper from the Keweenaw Peninsula, Michigan, about 2.5 inches (6.4 cm) long
Copper is produced in massive stars[22] and is present in the Earth’s crust in a proportion of about 50 parts per million (ppm).[23] In nature, copper occurs in a variety of minerals, including native copper, copper sulfides such as chalcopyrite, bornite, digenite, covellite, and chalcocite, copper sulfosalts such as tetrahedite-tennantite, and enargite, copper carbonates such as azurite and malachite, and as copper(I) or copper(II) oxides such as cuprite and tenorite, respectively.[11] The largest mass of elemental copper discovered weighed 420 tonnes and was found in 1857 on the Keweenaw Peninsula in Michigan, US.[23] Native copper is a polycrystal, with the largest single crystal ever described measuring 4.4 × 3.2 × 3.2 cm.[24] Copper is the 25th most abundant element in Earth’s crust, representing 50 ppm compared with 75 ppm for zinc, and 14 ppm for lead.[25]
Typical background concentrations of copper do not exceed 1 ng/m3 in the atmosphere; 150 mg/kg in soil; 30 mg/kg in vegetation; 2 μg/L in freshwater and 0.5 μg/L in seawater.[26]
Production
Most copper is mined or extracted as copper sulfides from large open pit mines in porphyry copper deposits that contain 0.4 to 1.0% copper. Sites include Chuquicamata, in Chile, Bingham Canyon Mine, in Utah, United States, and El Chino Mine, in New Mexico, United States. According to the British Geological Survey, in 2005, Chile was the top producer of copper with at least one-third of the world share followed by the United States, Indonesia and Peru.[11] Copper can also be recovered through the in-situ leach process. Several sites in the state of Arizona are considered prime candidates for this method.[27] The amount of copper in use is increasing and the quantity available is barely sufficient to allow all countries to reach developed world levels of usage.[28] An alternative source of copper for collection currently being researched are polymetallic nodules, which are located at the depths of the Pacific Ocean approximately 3000–6500 meters below sea level. These nodules contain other valuable metals such as cobalt and nickel.[29]
Reserves and prices
Price of Copper 1959-2022
Copper has been in use at least 10,000 years, but more than 95% of all copper ever mined and smelted has been extracted since 1900.[30] As with many natural resources, the total amount of copper on Earth is vast, with around 1014 tons in the top kilometer of Earth’s crust, which is about 5 million years’ worth at the current rate of extraction. However, only a tiny fraction of these reserves is economically viable with present-day prices and technologies. Estimates of copper reserves available for mining vary from 25 to 60 years, depending on core assumptions such as the growth rate.[31] Recycling is a major source of copper in the modern world.[30] Because of these and other factors, the future of copper production and supply is the subject of much debate, including the concept of peak copper, analogous to peak oil.[citation needed]
The price of copper has historically been unstable,[32] and its price increased from the 60-year low of US$0.60/lb (US$1.32/kg) in June 1999 to $3.75 per pound ($8.27/kg) in May 2006. It dropped to $2.40/lb ($5.29/kg) in February 2007, then rebounded to $3.50/lb ($7.71/kg) in April 2007.[33][better source needed] In February 2009, weakening global demand and a steep fall in commodity prices since the previous year’s highs left copper prices at $1.51/lb ($3.32/kg).[34] Between September 2010 and February 2011, the price of copper rose from £5,000 a metric ton to £6,250 a metric ton.[35]
Methods
Scheme of flash smelting process
The concentration of copper in ores averages only 0.6%, and most commercial ores are sulfides, especially chalcopyrite (CuFeS2), bornite (Cu5FeS4) and, to a lesser extent, covellite (CuS) and chalcocite (Cu2S).[36] Conversely, the average concentration of copper in polymetallic nodules is estimated at 1.3%. The methods of extracting copper as well as other metals found in these nodules include sulphuric leaching, smelting and an application of the Cuprion process.[37][38] For minerals found in land ores, they are concentrated from crushed ores to the level of 10–15% copper by froth flotation or bioleaching.[39] Heating this material with silica in flash smelting removes much of the iron as slag. The process exploits the greater ease of converting iron sulfides into oxides, which in turn react with the silica to form the silicate slag that floats on top of the heated mass. The resulting copper matte, consisting of Cu2S, is roasted to convert the sulfides into oxides:[36]
- 2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2
The cuprous oxide reacts with cuprous sulfide to converted to blister copper upon heating:
- 2 Cu2O + Cu2S → 6 Cu + 2 SO2
The Sudbury matte process converted only half the sulfide to oxide and then used this oxide to remove the rest of the sulfur as oxide. It was then electrolytically refined and the anode mud exploited for the platinum and gold it contained. This step exploits the relatively easy reduction of copper oxides to copper metal. Natural gas is blown across the blister to remove most of the remaining oxygen and electrorefining is performed on the resulting material to produce pure copper:[40]
- Cu2+ + 2 e− → Cu

Recycling
Like aluminium,[41] copper is recyclable without any loss of quality, both from raw state and from manufactured products.[42] In volume, copper is the third most recycled metal after iron and aluminium.[43] An estimated 80% of all copper ever mined is still in use today.[44] According to the International Resource Panel’s Metal Stocks in Society report, the global per capita stock of copper in use in society is 35–55 kg. Much of this is in more-developed countries (140–300 kg per capita) rather than less-developed countries (30–40 kg per capita).
The process of recycling copper is roughly the same as is used to extract copper but requires fewer steps. High-purity scrap copper is melted in a furnace and then reduced and cast into billets and ingots; lower-purity scrap is refined by electroplating in a bath of sulfuric acid.[45]
Alloys
Copper alloys are widely used in the production of coinage; seen here are two examples — post-1964 American dimes, which are composed of the alloy cupronickel[46] and a pre-1968 Canadian dime, which is composed of an alloy of 80 percent silver and 20 percent copper.[47]
Numerous copper alloys have been formulated, many with important uses. Brass is an alloy of copper and zinc. Bronze usually refers to copper-tin alloys, but can refer to any alloy of copper such as aluminium bronze. Copper is one of the most important constituents of silver and karat gold solders used in the jewelry industry, modifying the color, hardness and melting point of the resulting alloys.[48] Some lead-free solders consist of tin alloyed with a small proportion of copper and other metals.[49]
The alloy of copper and nickel, called cupronickel, is used in low-denomination coins, often for the outer cladding. The US five-cent coin (currently called a nickel) consists of 75% copper and 25% nickel in homogeneous composition. Prior to the introduction of cupronickel, which was widely adopted by countries in the latter half of the 20th century,[50] alloys of copper and silver were also used, with the United States using an alloy of 90% silver and 10% copper until 1965, when circulating silver was removed from all coins with the exception of the Half dollar — these were debased to an alloy of 40% silver and 60% copper between 1965 and 1970.[51] The alloy of 90% copper and 10% nickel, remarkable for its resistance to corrosion, is used for various objects exposed to seawater, though it is vulnerable to the sulfides sometimes found in polluted harbors and estuaries.[52] Alloys of copper with aluminium (about 7%) have a golden color and are used in decorations.[23] Shakudō is a Japanese decorative alloy of copper containing a low percentage of gold, typically 4–10%, that can be patinated to a dark blue or black color.[53]
Compounds
Copper forms a rich variety of compounds, usually with oxidation states +1 and +2, which are often called cuprous and cupric, respectively.[54] Copper compounds, whether organic complexes or organometallics, promote or catalyse numerous chemical and biological processes.[55]
Binary compounds
As with other elements, the simplest compounds of copper are binary compounds, i.e. those containing only two elements, the principal examples being oxides, sulfides, and halides. Both cuprous and cupric oxides are known. Among the numerous copper sulfides, important examples include copper(I) sulfide and copper(II) sulfide.[citation needed]
Cuprous halides with fluorine, chlorine, bromine, and iodine are known, as are cupric halides with fluorine, chlorine, and bromine. Attempts to prepare copper(II) iodide yield only copper(I) iodide and iodine.[54]
- 2 Cu2+ + 4 I− → 2 CuI + I2
Coordination chemistry
Copper forms coordination complexes with ligands. In aqueous solution, copper(II) exists as [Cu(H
2O)
6]2+
. This complex exhibits the fastest water exchange rate (speed of water ligands attaching and detaching) for any transition metal aquo complex. Adding aqueous sodium hydroxide causes the precipitation of light blue solid copper(II) hydroxide. A simplified equation is:
Pourbaix diagram for copper in uncomplexed media (anions other than OH- not considered). Ion concentration 0.001 m (mol/kg water). Temperature 25 °C.
- Cu2+ + 2 OH− → Cu(OH)2
Aqueous ammonia results in the same precipitate. Upon adding excess ammonia, the precipitate dissolves, forming tetraamminecopper(II):
- Cu(H
2O)
4(OH)
2 + 4 NH3 → [Cu(H
2O)
2(NH
3)
4]2+
+ 2 H2O + 2 OH−
Many other oxyanions form complexes; these include copper(II) acetate, copper(II) nitrate, and copper(II) carbonate. Copper(II) sulfate forms a blue crystalline pentahydrate, the most familiar copper compound in the laboratory. It is used in a fungicide called the Bordeaux mixture.[56]
Polyols, compounds containing more than one alcohol functional group, generally interact with cupric salts. For example, copper salts are used to test for reducing sugars. Specifically, using Benedict’s reagent and Fehling’s solution the presence of the sugar is signaled by a color change from blue Cu(II) to reddish copper(I) oxide.[57] Schweizer’s reagent and related complexes with ethylenediamine and other amines dissolve cellulose.[58] Amino acids such as cystine form very stable chelate complexes with copper(II)[59][60][61] including in the form of metal-organic biohybrids (MOBs). Many wet-chemical tests for copper ions exist, one involving potassium ferrocyanide, which gives a brown precipitate with copper(II) salts.[citation needed]
Organocopper chemistry
Compounds that contain a carbon-copper bond are known as organocopper compounds. They are very reactive towards oxygen to form copper(I) oxide and have many uses in chemistry. They are synthesized by treating copper(I) compounds with Grignard reagents, terminal alkynes or organolithium reagents;[62] in particular, the last reaction described produces a Gilman reagent. These can undergo substitution with alkyl halides to form coupling products; as such, they are important in the field of organic synthesis. Copper(I) acetylide is highly shock-sensitive but is an intermediate in reactions such as the Cadiot-Chodkiewicz coupling[63] and the Sonogashira coupling.[64] Conjugate addition to enones[65] and carbocupration of alkynes[66] can also be achieved with organocopper compounds. Copper(I) forms a variety of weak complexes with alkenes and carbon monoxide, especially in the presence of amine ligands.[67]
Copper(III) and copper(IV)
Copper(III) is most often found in oxides. A simple example is potassium cuprate, KCuO2, a blue-black solid.[68] The most extensively studied copper(III) compounds are the cuprate superconductors. Yttrium barium copper oxide (YBa2Cu3O7) consists of both Cu(II) and Cu(III) centres. Like oxide, fluoride is a highly basic anion[69] and is known to stabilize metal ions in high oxidation states. Both copper(III) and even copper(IV) fluorides are known, K3CuF6 and Cs2CuF6, respectively.[54]
Some copper proteins form oxo complexes, which also feature copper(III).[70] With tetrapeptides, purple-colored copper(III) complexes are stabilized by the deprotonated amide ligands.[71]
Complexes of copper(III) are also found as intermediates in reactions of organocopper compounds.[72] For example, in the Kharasch–Sosnovsky reaction.[citation needed]
History
A timeline of copper illustrates how this metal has advanced human civilization for the past 11,000 years.[73]
Prehistoric
Copper Age
A corroded copper ingot from Zakros, Crete, shaped in the form of an animal skin (oxhide) typical in that era.
Many tools during the Chalcolithic Era included copper, such as the blade of this replica of Ötzi’s axe
Copper occurs naturally as native metallic copper and was known to some of the oldest civilizations on record. The history of copper use dates to 9000 BC in the Middle East;[74] a copper pendant was found in northern Iraq that dates to 8700 BC.[75] Evidence suggests that gold and meteoric iron (but not smelted iron) were the only metals used by humans before copper.[76] The history of copper metallurgy is thought to follow this sequence: First, cold working of native copper, then annealing, smelting, and, finally, lost-wax casting. In southeastern Anatolia, all four of these techniques appear more or less simultaneously at the beginning of the Neolithic c. 7500 BC.[77]
Copper smelting was independently invented in different places. It was probably discovered in China before 2800 BC, in Central America around 600 AD, and in West Africa about the 9th or 10th century AD.[78] Investment casting was invented in 4500–4000 BC in Southeast Asia[74] and carbon dating has established mining at Alderley Edge in Cheshire, UK, at 2280 to 1890 BC.[79] Ötzi the Iceman, a male dated from 3300 to 3200 BC, was found with an axe with a copper head 99.7% pure; high levels of arsenic in his hair suggest an involvement in copper smelting.[80] Experience with copper has assisted the development of other metals; in particular, copper smelting led to the discovery of iron smelting.[80] Production in the Old Copper Complex in Michigan and Wisconsin is dated between 6000 and 3000 BC.[81][82] Natural bronze, a type of copper made from ores rich in silicon, arsenic, and (rarely) tin, came into general use in the Balkans around 5500 BC.[83]
Bronze Age
Alloying copper with tin to make bronze was first practiced about 4000 years after the discovery of copper smelting, and about 2000 years after «natural bronze» had come into general use.[84] Bronze artifacts from the Vinča culture date to 4500 BC.[85] Sumerian and Egyptian artifacts of copper and bronze alloys date to 3000 BC.[86] The Bronze Age began in Southeastern Europe around 3700–3300 BC, in Northwestern Europe about 2500 BC. It ended with the beginning of the Iron Age, 2000–1000 BC in the Near East, and 600 BC in Northern Europe. The transition between the Neolithic period and the Bronze Age was formerly termed the Chalcolithic period (copper-stone), when copper tools were used with stone tools. The term has gradually fallen out of favor because in some parts of the world, the Chalcolithic and Neolithic are coterminous at both ends. Brass, an alloy of copper and zinc, is of much more recent origin. It was known to the Greeks, but became a significant supplement to bronze during the Roman Empire.[86]
Ancient and post-classical
In alchemy the symbol for copper was also the symbol for the goddess and planet Venus.
In Greece, copper was known by the name chalkos (χαλκός). It was an important resource for the Romans, Greeks and other ancient peoples. In Roman times, it was known as aes Cyprium, aes being the generic Latin term for copper alloys and Cyprium from Cyprus, where much copper was mined. The phrase was simplified to cuprum, hence the English copper. Aphrodite (Venus in Rome) represented copper in mythology and alchemy because of its lustrous beauty and its ancient use in producing mirrors; Cyprus, the source of copper, was sacred to the goddess. The seven heavenly bodies known to the ancients were associated with the seven metals known in antiquity, and Venus was assigned to copper, both because of the connection to the goddess and because Venus was the brightest heavenly body after the Sun and Moon and so corresponded to the most lustrous and desirable metal after gold and silver.[87]
Copper was first mined in ancient Britain as early as 2100 BC. Mining at the largest of these mines, the Great Orme, continued into the late Bronze Age. Mining seems to have been largely restricted to supergene ores, which were easier to smelt. The rich copper deposits of Cornwall seem to have been largely untouched, in spite of extensive tin mining in the region, for reasons likely social and political rather than technological.[88]
In North America, copper mining began with marginal workings by Native Americans. Native copper is known to have been extracted from sites on Isle Royale with primitive stone tools between 800 and 1600.[89] Copper metallurgy was flourishing in South America, particularly in Peru around 1000 AD. Copper burial ornamentals from the 15th century have been uncovered, but the metal’s commercial production did not start until the early 20th century.[citation needed]
The cultural role of copper has been important, particularly in currency. Romans in the 6th through 3rd centuries BC used copper lumps as money. At first, the copper itself was valued, but gradually the shape and look of the copper became more important. Julius Caesar had his own coins made from brass, while Octavianus Augustus Caesar’s coins were made from Cu-Pb-Sn alloys. With an estimated annual output of around 15,000 t, Roman copper mining and smelting activities reached a scale unsurpassed until the time of the Industrial Revolution; the provinces most intensely mined were those of Hispania, Cyprus and in Central Europe.[90][91]
The gates of the Temple of Jerusalem used Corinthian bronze treated with depletion gilding.[clarification needed][citation needed] The process was most prevalent in Alexandria, where alchemy is thought to have begun.[92] In ancient India, copper was used in the holistic medical science Ayurveda for surgical instruments and other medical equipment. Ancient Egyptians (~2400 BC) used copper for sterilizing wounds and drinking water, and later to treat headaches, burns, and itching.[citation needed]
Modern
18th-century copper kettle from Norway made from Swedish copper
The Great Copper Mountain was a mine in Falun, Sweden, that operated from the 10th century to 1992. It satisfied two-thirds of Europe’s copper consumption in the 17th century and helped fund many of Sweden’s wars during that time.[93] It was referred to as the nation’s treasury; Sweden had a copper backed currency.[94]
Chalcography of the city of Vyborg at the turn of the 17th and 18th centuries. The year 1709 carved on the printing plate.
Copper is used in roofing,[16] currency, and for photographic technology known as the daguerreotype. Copper was used in Renaissance sculpture, and was used to construct the Statue of Liberty; copper continues to be used in construction of various types. Copper plating and copper sheathing were widely used to protect the under-water hulls of ships, a technique pioneered by the British Admiralty in the 18th century.[95] The Norddeutsche Affinerie in Hamburg was the first modern electroplating plant, starting its production in 1876.[96] The German scientist Gottfried Osann invented powder metallurgy in 1830 while determining the metal’s atomic mass; around then it was discovered that the amount and type of alloying element (e.g., tin) to copper would affect bell tones.[citation needed]
During the rise in demand for copper for the Age of Electricity, from the 1880s until the Great Depression of the 1930s, the United States produced one third to half the world’s newly mined copper.[97] Major districts included the Keweenaw district of northern Michigan, primarily native copper deposits, which was eclipsed by the vast sulphide deposits of Butte, Montana in the late 1880s, which itself was eclipsed by porphyry deposits of the Souhwest United States, especially at Bingham Canyon, Utah and Morenci, Arizona. Introduction of open pit steam shovel mining and innovations in smelting, refining, flotation concentration and other processing steps led to mass production. Early in the twentieth century, Arizona ranked first, followed by Montana, then Utah and Michigan.[98]
Flash smelting was developed by Outokumpu in Finland and first applied at Harjavalta in 1949; the energy-efficient process accounts for 50% of the world’s primary copper production.[99]
The Intergovernmental Council of Copper Exporting Countries, formed in 1967 by Chile, Peru, Zaire and Zambia, operated in the copper market as OPEC does in oil, though it never achieved the same influence, particularly because the second-largest producer, the United States, was never a member; it was dissolved in 1988.[100]
Applications
Copper fittings for soldered plumbing joints
The major applications of copper are electrical wire (60%), roofing and plumbing (20%), and industrial machinery (15%). Copper is used mostly as a pure metal, but when greater hardness is required, it is put into such alloys as brass and bronze (5% of total use).[23] For more than two centuries, copper paint has been used on boat hulls to control the growth of plants and shellfish.[101] A small part of the copper supply is used for nutritional supplements and fungicides in agriculture.[56][102] Machining of copper is possible, although alloys are preferred for good machinability in creating intricate parts.
Wire and cable
Despite competition from other materials, copper remains the preferred electrical conductor in nearly all categories of electrical wiring except overhead electric power transmission where aluminium is often preferred.[103][104] Copper wire is used in power generation, power transmission, power distribution, telecommunications, electronics circuitry, and countless types of electrical equipment.[105] Electrical wiring is the most important market for the copper industry.[106] This includes structural power wiring, power distribution cable, appliance wire, communications cable, automotive wire and cable, and magnet wire. Roughly half of all copper mined is used for electrical wire and cable conductors.[107] Many electrical devices rely on copper wiring because of its multitude of inherent beneficial properties, such as its high electrical conductivity, tensile strength, ductility, creep (deformation) resistance, corrosion resistance, low thermal expansion, high thermal conductivity, ease of soldering, malleability, and ease of installation.
For a short period from the late 1960s to the late 1970s, copper wiring was replaced by aluminium wiring in many housing construction projects in America. The new wiring was implicated in a number of house fires and the industry returned to copper.[108]
Electronics and related devices
Copper electrical busbars distributing power to a large building
Integrated circuits and printed circuit boards increasingly feature copper in place of aluminium because of its superior electrical conductivity; heat sinks and heat exchangers use copper because of its superior heat dissipation properties. Electromagnets, vacuum tubes, cathode ray tubes, and magnetrons in microwave ovens use copper, as do waveguides for microwave radiation.[109]
Electric motors
Copper’s superior conductivity enhances the efficiency of electrical motors.[110] This is important because motors and motor-driven systems account for 43%–46% of all global electricity consumption and 69% of all electricity used by industry.[111] Increasing the mass and cross section of copper in a coil increases the efficiency of the motor. Copper motor rotors, a new technology designed for motor applications where energy savings are prime design objectives,[112][113] are enabling general-purpose induction motors to meet and exceed National Electrical Manufacturers Association (NEMA) premium efficiency standards.[114]
Renewable energy production
Renewable energy sources such as solar, wind, tidal, hydro, biomass, and geothermal have become significant sectors of the energy market.[115][116] The rapid growth of these sources in the 21st century has been prompted by increasing costs of fossil fuels as well as their environmental impact issues that significantly lowered their use.
Copper plays an important role in these renewable energy systems.[117][118][119][120][121] Copper usage averages up to five times more in renewable energy systems than in traditional power generation, such as fossil fuel and nuclear power plants.[122] Since copper is an excellent thermal and electrical conductor among engineering metals (second only to silver),[123] electrical systems that utilize copper generate and transmit energy with high efficiency and with minimum environmental impacts.
When choosing electrical conductors, facility planners and engineers factor capital investment costs of materials against operational savings due to their electrical energy efficiencies over their useful lives, plus maintenance costs. Copper often fares well in these calculations. A factor called «copper usage intensity,” is a measure of the quantity of copper necessary to install one megawatt of new power-generating capacity.
Copper wires for recycling
When planning for a new renewable power facility, engineers and product specifiers seek to avoid supply shortages of selected materials. According to the United States Geological Survey, in-ground copper reserves have increased more than 700% since 1950, from almost 100 million tonnes to 720 million tonnes in 2017, despite the fact that world refined usage has more than tripled in the last 50 years.[124] Copper resources are estimated to exceed 5,000 million tonnes.[125][126]
Bolstering the supply from copper extraction is the fact that more than 30 percent of copper installed during the last decade came from recycled sources.[127] Its recycling rate is higher than any other metal.[128]
This article discusses the role of copper in various renewable energy generation systems.
Architecture
Old copper utensils in a Jerusalem restaurant
Copper has been used since ancient times as a durable, corrosion resistant, and weatherproof architectural material.[129][130][131][132] Roofs, flashings, rain gutters, downspouts, domes, spires, vaults, and doors have been made from copper for hundreds or thousands of years. Copper’s architectural use has been expanded in modern times to include interior and exterior wall cladding, building expansion joints, radio frequency shielding, and antimicrobial and decorative indoor products such as attractive handrails, bathroom fixtures, and counter tops. Some of copper’s other important benefits as an architectural material include low thermal movement, light weight, lightning protection, and recyclability
The metal’s distinctive natural green patina has long been coveted by architects and designers. The final patina is a particularly durable layer that is highly resistant to atmospheric corrosion, thereby protecting the underlying metal against further weathering.[133][134][135] It can be a mixture of carbonate and sulfate compounds in various amounts, depending upon environmental conditions such as sulfur-containing acid rain.[136][137][138][139] Architectural copper and its alloys can also be ‘finished’ to take on a particular look, feel, or color. Finishes include mechanical surface treatments, chemical coloring, and coatings.[140]
Copper has excellent brazing and soldering properties and can be welded; the best results are obtained with gas metal arc welding.[141]
Antibiofouling
Copper is biostatic, meaning bacteria and many other forms of life will not grow on it. For this reason it has long been used to line parts of ships to protect against barnacles and mussels. It was originally used pure, but has since been superseded by Muntz metal and copper-based paint. Similarly, as discussed in copper alloys in aquaculture, copper alloys have become important netting materials in the aquaculture industry because they are antimicrobial and prevent biofouling, even in extreme conditions[142] and have strong structural and corrosion-resistant[143] properties in marine environments.
Antimicrobial
Copper-alloy touch surfaces have natural properties that destroy a wide range of microorganisms (e.g., E. coli O157:H7, methicillin-resistant Staphylococcus aureus (MRSA), Staphylococcus, Clostridium difficile, influenza A virus, adenovirus, SARS-Cov-2, and fungi).[144][145] Indians have been using copper vessels since ancient times for storing water, even before modern science realized its antimicrobial properties.[146] Some copper alloys were proven to kill more than 99.9% of disease-causing bacteria within just two hours when cleaned regularly.[147] The United States Environmental Protection Agency (EPA) has approved the registrations of these copper alloys as «antimicrobial materials with public health benefits»;[147] that approval allows manufacturers to make legal claims to the public health benefits of products made of registered alloys. In addition, the EPA has approved a long list of antimicrobial copper products made from these alloys, such as bedrails, handrails, over-bed tables, sinks, faucets, door knobs, toilet hardware, computer keyboards, health club equipment, and shopping cart handles (for a comprehensive list, see: Antimicrobial copper-alloy touch surfaces#Approved products). Copper doorknobs are used by hospitals to reduce the transfer of disease, and Legionnaires’ disease is suppressed by copper tubing in plumbing systems.[148] Antimicrobial copper alloy products are now being installed in healthcare facilities in the U.K., Ireland, Japan, Korea, France, Denmark, and Brazil, as well as being called for in the US,[149] and in the subway transit system in Santiago, Chile, where copper-zinc alloy handrails were installed in some 30 stations between 2011 and 2014.[150][151][152]
Textile fibers can be blended with copper to create antimicrobial protective fabrics.[153][unreliable source?]
Speculative investing
Copper may be used as a speculative investment due to the predicted increase in use from worldwide infrastructure growth, and the important role it has in producing wind turbines, solar panels, and other renewable energy sources.[154][155] Another reason predicted demand increases is the fact that electric cars contain an average of 3.6 times as much copper as conventional cars, although the effect of electric cars on copper demand is debated.[156][157] Some people invest in copper through copper mining stocks, ETFs, and futures. Others store physical copper in the form of copper bars or rounds although these tend to carry a higher premium in comparison to precious metals.[158] Those who want to avoid the premiums of copper bullion alternatively store old copper wire, copper tubing or American pennies made before 1982.[159]
Folk medicine
Copper is commonly used in jewelry, and according to some folklore, copper bracelets relieve arthritis symptoms.[160] In one trial for osteoarthritis and one trial for rheumatoid arthritis, no differences is found between copper bracelet and control (non-copper) bracelet.[161][162] No evidence shows that copper can be absorbed through the skin. If it were, it might lead to copper poisoning.[163]
Compression clothing
Recently, some compression clothing with inter-woven copper has been marketed with health claims similar to the folk medicine claims. Because compression clothing is a valid treatment for some ailments, the clothing may have that benefit, but the added copper may have no benefit beyond a placebo effect.[164]
Degradation
Chromobacterium violaceum and Pseudomonas fluorescens can both mobilize solid copper as a cyanide compound.[165] The ericoid mycorrhizal fungi associated with Calluna, Erica and Vaccinium can grow in metalliferous soils containing copper.[165] The ectomycorrhizal fungus Suillus luteus protects young pine trees from copper toxicity. A sample of the fungus Aspergillus niger was found growing from gold mining solution and was found to contain cyano complexes of such metals as gold, silver, copper, iron, and zinc. The fungus also plays a role in the solubilization of heavy metal sulfides.[166]
Biological role
Rich sources of copper include oysters, beef and lamb liver, Brazil nuts, blackstrap molasses, cocoa, and black pepper. Good sources include lobster, nuts and sunflower seeds, green olives, avocados, and wheat bran.
Biochemistry
Copper proteins have diverse roles in biological electron transport and oxygen transportation, processes that exploit the easy interconversion of Cu(I) and Cu(II).[167] Copper is essential in the aerobic respiration of all eukaryotes. In mitochondria, it is found in cytochrome c oxidase, which is the last protein in oxidative phosphorylation. Cytochrome c oxidase is the protein that binds the O2 between a copper and an iron; the protein transfers 8 electrons to the O2 molecule to reduce it to two molecules of water. Copper is also found in many superoxide dismutases, proteins that catalyze the decomposition of superoxides by converting it (by disproportionation) to oxygen and hydrogen peroxide:
- Cu2+-SOD + O2− → Cu+-SOD + O2 (reduction of copper; oxidation of superoxide)
- Cu+-SOD + O2− + 2H+ → Cu2+-SOD + H2O2 (oxidation of copper; reduction of superoxide)
The protein hemocyanin is the oxygen carrier in most mollusks and some arthropods such as the horseshoe crab (Limulus polyphemus).[168] Because hemocyanin is blue, these organisms have blue blood rather than the red blood of iron-based hemoglobin. Structurally related to hemocyanin are the laccases and tyrosinases. Instead of reversibly binding oxygen, these proteins hydroxylate substrates, illustrated by their role in the formation of lacquers.[169] The biological role for copper commenced with the appearance of oxygen in earth’s atmosphere.[170] Several copper proteins, such as the «blue copper proteins», do not interact directly with substrates; hence they are not enzymes. These proteins relay electrons by the process called electron transfer.[169]
Photosynthesis functions by an elaborate electron transport chain within the thylakoid membrane. A central link in this chain is plastocyanin, a blue copper protein.
A unique tetranuclear copper center has been found in nitrous-oxide reductase.[171]
Chemical compounds which were developed for treatment of Wilson’s disease have been investigated for use in cancer therapy.[172]
Nutrition
Copper is an essential trace element in plants and animals, but not all microorganisms. The human body contains copper at a level of about 1.4 to 2.1 mg per kg of body mass.[173]
Absorption
Copper is absorbed in the gut, then transported to the liver bound to albumin.[174] After processing in the liver, copper is distributed to other tissues in a second phase, which involves the protein ceruloplasmin, carrying the majority of copper in blood. Ceruloplasmin also carries the copper that is excreted in milk, and is particularly well-absorbed as a copper source.[175] Copper in the body normally undergoes enterohepatic circulation (about 5 mg a day, vs. about 1 mg per day absorbed in the diet and excreted from the body), and the body is able to excrete some excess copper, if needed, via bile, which carries some copper out of the liver that is not then reabsorbed by the intestine.[176][177]
Dietary recommendations
The U.S. Institute of Medicine (IOM) updated the estimated average requirements (EARs) and recommended dietary allowances (RDAs) for copper in 2001. If there is not sufficient information to establish EARs and RDAs, an estimate designated Adequate Intake (AI) is used instead. The AIs for copper are: 200 μg of copper for 0–6-month-old males and females, and 220 μg of copper for 7–12-month-old males and females. For both sexes, the RDAs for copper are: 340 μg of copper for 1–3 years old, 440 μg of copper for 4–8 years old, 700 μg of copper for 9–13 years old, 890 μg of copper for 14–18 years old and 900 μg of copper for ages 19 years and older. For pregnancy, 1,000 μg. For lactation, 1,300 μg.[178] As for safety, the IOM also sets tolerable upper intake levels (ULs) for vitamins and minerals when evidence is sufficient. In the case of copper the UL is set at 10 mg/day. Collectively the EARs, RDAs, AIs and ULs are referred to as Dietary Reference Intakes.[179]
The European Food Safety Authority (EFSA) refers to the collective set of information as Dietary Reference Values, with Population Reference Intake (PRI) instead of RDA, and Average Requirement instead of EAR. AI and UL defined the same as in United States. For women and men ages 18 and older the AIs are set at 1.3 and 1.6 mg/day, respectively. AIs for pregnancy and lactation is 1.5 mg/day. For children ages 1–17 years the AIs increase with age from 0.7 to 1.3 mg/day. These AIs are higher than the U.S. RDAs.[180] The European Food Safety Authority reviewed the same safety question and set its UL at 5 mg/day, which is half the U.S. value.[181]
For U.S. food and dietary supplement labeling purposes the amount in a serving is expressed as a percent of Daily Value (%DV). For copper labeling purposes 100% of the Daily Value was 2.0 mg, but as of May 27, 2016 it was revised to 0.9 mg to bring it into agreement with the RDA.[182][183] A table of the old and new adult daily values is provided at Reference Daily Intake.
Deficiency
Because of its role in facilitating iron uptake, copper deficiency can produce anemia-like symptoms, neutropenia, bone abnormalities, hypopigmentation, impaired growth, increased incidence of infections, osteoporosis, hyperthyroidism, and abnormalities in glucose and cholesterol metabolism. Conversely, Wilson’s disease causes an accumulation of copper in body tissues.
Severe deficiency can be found by testing for low plasma or serum copper levels, low ceruloplasmin, and low red blood cell superoxide dismutase levels; these are not sensitive to marginal copper status. The «cytochrome c oxidase activity of leucocytes and platelets» has been stated as another factor in deficiency, but the results have not been confirmed by replication.[184]
Toxicity
Gram quantities of various copper salts have been taken in suicide attempts and produced acute copper toxicity in humans, possibly due to redox cycling and the generation of reactive oxygen species that damage DNA.[185][186] Corresponding amounts of copper salts (30 mg/kg) are toxic in animals.[187] A minimum dietary value for healthy growth in rabbits has been reported to be at least 3 ppm in the diet.[188] However, higher concentrations of copper (100 ppm, 200 ppm, or 500 ppm) in the diet of rabbits may favorably influence feed conversion efficiency, growth rates, and carcass dressing percentages.[189]
Chronic copper toxicity does not normally occur in humans because of transport systems that regulate absorption and excretion. Autosomal recessive mutations in copper transport proteins can disable these systems, leading to Wilson’s disease with copper accumulation and cirrhosis of the liver in persons who have inherited two defective genes.[173]
Elevated copper levels have also been linked to worsening symptoms of Alzheimer’s disease.[190][191]
Human exposure
In the US, the Occupational Safety and Health Administration (OSHA) has designated a permissible exposure limit (PEL) for copper dust and fumes in the workplace as a time-weighted average (TWA) of 1 mg/m3.[192] The National Institute for Occupational Safety and Health (NIOSH) has set a recommended exposure limit (REL) of 1 mg/m3, time-weighted average. The IDLH (immediately dangerous to life and health) value is 100 mg/m3.[193]
Copper is a constituent of tobacco smoke.[194][195] The tobacco plant readily absorbs and accumulates heavy metals, such as copper from the surrounding soil into its leaves. These are readily absorbed into the user’s body following smoke inhalation.[196] The health implications are not clear.[197]
See also
- Copper in renewable energy
- Copper nanoparticle
- Erosion corrosion of copper water tubes
- Cold water pitting of copper tube
- List of countries by copper production
- Metal theft
- Operation Tremor
- Anaconda Copper
- Antofagasta PLC
- Codelco
- El Boleo mine
- Grasberg mine
References
- ^ «Standard Atomic Weights: Copper». CIAAW. 1969.
- ^ Moret, Marc-Etienne; Zhang, Limei; Peters, Jonas C. (2013). «A Polar Copper–Boron One-Electron σ-Bond». J. Am. Chem. Soc. 135 (10): 3792–3795. doi:10.1021/ja4006578. PMID 23418750.
- ^ Lide, D. R., ed. (2005). «Magnetic susceptibility of the elements and inorganic compounds». CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5. Archived from the original (PDF) on 3 March 2011.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Robert McHenry, ed. (1992). «Bronze». The New Encyclopædia Britannica. Vol. 3 (15 ed.). Chicago: Encyclopædia Britannica, Incorporated. p. 612. ISBN 978-0-85229-553-3. OCLC 25228234.
- ^ «Copper». Merriam-Webster Dictionary. 2018. Retrieved 22 August 2018.
- ^ Johnson, MD PhD, Larry E., ed. (2008). «Copper». Merck Manual Home Health Handbook. Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc. Archived from the original on 7 March 2016. Retrieved 7 April 2013.
- ^ «Copper in human health».
- ^ a b Trigg, George L.; Immergut, Edmund H. (1992). Encyclopedia of Applied Physics. Vol. 4: Combustion to Diamagnetism. VCH. pp. 267–272. ISBN 978-3-527-28126-8. Retrieved 2 May 2011.
- ^ Smith, William F. & Hashemi, Javad (2003). Foundations of Materials Science and Engineering. McGraw-Hill Professional. p. 223. ISBN 978-0-07-292194-6.
- ^ a b c Hammond, C. R. (2004). The Elements, in Handbook of Chemistry and Physics (81st ed.). CRC Press. ISBN 978-0-8493-0485-9.
- ^ Resistance Welding Manufacturing Alliance (2003). Resistance Welding Manual (4th ed.). Resistance Welding Manufacturing Alliance. pp. 18–12. ISBN 978-0-9624382-0-2.
- ^ Chambers, William; Chambers, Robert (1884). Chambers’s Information for the People. Vol. L (5th ed.). W. & R. Chambers. p. 312. ISBN 978-0-665-46912-1.
- ^ Ramachandran, Harishankar (14 March 2007). «Why is Copper Red?» (PDF). IIT Madras. Retrieved 27 December 2022.
- ^ «Galvanic Corrosion». Corrosion Doctors. Retrieved 29 April 2011.
- ^ a b Grieken, Rene van; Janssens, Koen (2005). Cultural Heritage Conservation and Environmental Impact Assessment by Non-Destructive Testing and Micro-Analysis. CRC Press. p. 197. ISBN 978-0-203-97078-2.
- ^ «Copper.org: Education: Statue of Liberty: Reclothing the First Lady of Metals – Repair Concerns». Copper.org. Retrieved 11 April 2011.
- ^ Rickett, B. I.; Payer, J. H. (1995). «Composition of Copper Tarnish Products Formed in Moist Air with Trace Levels of Pollutant Gas: Hydrogen Sulfide and Sulfur Dioxide/Hydrogen Sulfide». Journal of the Electrochemical Society. 142 (11): 3723–3728. Bibcode:1995JElS..142.3723R. doi:10.1149/1.2048404.
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ «Interactive Chart of Nuclides». National Nuclear Data Center. Archived from the original on 25 August 2013. Retrieved 8 April 2011.
- ^ Okazawad, Hidehiko; Yonekura, Yoshiharu; Fujibayashi, Yasuhisa; Nishizawa, Sadahiko; Magata, Yasuhiro; Ishizu, Koichi; Tanaka, Fumiko; Tsuchida, Tatsuro; Tamaki, Nagara; Konishi, Junji (1994). «Clinical Application and Quantitative Evaluation of Generator-Produced Copper-62-PTSM as a Brain Perfusion Tracer for PET» (PDF). Journal of Nuclear Medicine. 35 (12): 1910–1915. PMID 7989968.
- ^ Romano, Donatella; Matteucci, Fransesca (2007). «Contrasting copper evolution in ω Centauri and the Milky Way». Monthly Notices of the Royal Astronomical Society: Letters. 378 (1): L59–L63. arXiv:astro-ph/0703760. Bibcode:2007MNRAS.378L..59R. doi:10.1111/j.1745-3933.2007.00320.x. S2CID 14595800.
- ^ a b c d Emsley, John (2003). Nature’s building blocks: an A–Z guide to the elements. Oxford University Press. pp. 121–125. ISBN 978-0-19-850340-8. Retrieved 2 May 2011.
- ^ Rickwood, P. C. (1981). «The largest crystals» (PDF). American Mineralogist. 66: 885.
- ^ Emsley, John (2003). Nature’s building blocks: an A–Z guide to the elements. Oxford University Press. pp. 124, 231, 449, 503. ISBN 978-0-19-850340-8. Retrieved 2 May 2011.
- ^ Rieuwerts, John (2015). The Elements of Environmental Pollution. London and New York: Earthscan Routledge. p. 207. ISBN 978-0-415-85919-6. OCLC 886492996.
- ^ Randazzo, Ryan (19 June 2011). «A new method to harvest copper». Azcentral.com. Retrieved 25 April 2014.
- ^ Gordon, R.B.; Bertram, M.; Graedel, T.E. (2006). «Metal stocks and sustainability». Proceedings of the National Academy of Sciences. 103 (5): 1209–1214. Bibcode:2006PNAS..103.1209G. doi:10.1073/pnas.0509498103. PMC 1360560. PMID 16432205.
- ^ Beaudoin, Yannick C.; Baker, Elaine (December 2013). Deep Sea Minerals: Manganese Nodules, a physical, biological, environmental and technical review. Secretariat of the Pacific Community. pp. 7–18. ISBN 978-82-7701-119-6. Retrieved 8 February 2021.
- ^ a b Leonard, Andrew (3 March 2006). «Peak copper?». Salon. Retrieved 8 March 2022.
- ^ Brown, Lester (2006). Plan B 2.0: Rescuing a Planet Under Stress and a Civilization in Trouble. New York: W.W. Norton. p. 109. ISBN 978-0-393-32831-8.
- ^ Schmitz, Christopher (1986). «The Rise of Big Business in the World, Copper Industry 1870–1930». Economic History Review. 2. 39 (3): 392–410. doi:10.1111/j.1468-0289.1986.tb00411.x. JSTOR 2596347.
- ^ «Copper Trends: Live Metal Spot Prices». Archived from the original on 1 May 2012.
- ^ Ackerman, R. (2 April 2009). «A Bottom in Sight For Copper». Forbes. Archived from the original on 8 December 2012.
- ^ Employment Appeal Tribunal, AEI Cables Ltd. v GMB and others, 5 April 2013, accessed 5 February 2021
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Su, Kun; Ma, Xiaodong; Parianos, John; Zhao, Baojun (2020). «Thermodynamic and Experimental Study on Efficient Extraction of Valuable Metals from Polymetallic Nodules». Minerals. 10 (4): 360. Bibcode:2020Mine…10..360S. doi:10.3390/min10040360.
- ^ International Seabed Authority. «Polymetallic Nodules» (PDF). International Seabed Authority. Retrieved 8 February 2021.
- ^ Watling, H.R. (2006). «The bioleaching of sulphide minerals with emphasis on copper sulphides – A review» (PDF). Hydrometallurgy. 84 (1): 81–108. doi:10.1016/j.hydromet.2006.05.001. Archived from the original (PDF) on 18 August 2011.
- ^ Samans, Carl (1949). Engineering metals and their alloys. New York: Macmillan. OCLC 716492542.
- ^ Burton, Julie McCulloch (2015). Pen to Paper: Making Fun of Life. iUniverse. ISBN 978-1-4917-5394-1.
- ^ Bahadir, Ali Mufit; Duca, Gheorghe (2009). The Role of Ecological Chemistry in Pollution Research and Sustainable Development. Springer. ISBN 978-90-481-2903-4.
- ^ Green, Dan (2016). The Periodic Table in Minutes. Quercus. ISBN 978-1-68144-329-4.
- ^ «International Copper Association». Archived from the original on 5 March 2012. Retrieved 22 July 2009.
- ^ «Overview of Recycled Copper» Copper.org. (25 August 2010). Retrieved on 8 November 2011.
- ^ «Dime». US Mint. Retrieved 9 July 2019.[permanent dead link]
- ^ «Pride and skill – the 10-cent coin». Royal Canadian Mint. Retrieved 9 July 2019.
- ^ «Gold Jewellery Alloys». World Gold Council. Archived from the original on 14 April 2009. Retrieved 6 June 2009.
- ^ Balver Zinn Solder Sn97Cu3 Archived 7 July 2011 at the Wayback Machine. (PDF) . balverzinn.com. Retrieved on 8 November 2011.
- ^ Deane, D. V. «Modern Coinage Systems» (PDF). British Numismatic Society. Retrieved 1 July 2019.
- ^ «What is 90% Silver?». American Precious Metals Exchange (APMEX). Archived from the original on 28 July 2020. Retrieved 1 July 2019.
- ^ Corrosion Tests and Standards. ASTM International. 2005. p. 368.
- ^ Oguchi, Hachiro (1983). «Japanese Shakudō: its history, properties and production from gold-containing alloys». Gold Bulletin. 16 (4): 125–132. doi:10.1007/BF03214636.
- ^ a b c Holleman, A.F.; Wiberg, N. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ Trammell, Rachel; Rajabimoghadam, Khashayar; Garcia-Bosch, Isaac (30 January 2019). «Copper-Promoted Functionalization of Organic Molecules: from Biologically Relevant Cu/O2 Model Systems to Organometallic Transformations». Chemical Reviews. 119 (4): 2954–3031. doi:10.1021/acs.chemrev.8b00368. PMC 6571019. PMID 30698952.
- ^ a b Wiley-Vch (2 April 2007). «Nonsystematic (Contact) Fungicides». Ullmann’s Agrochemicals. p. 623. ISBN 978-3-527-31604-5.
- ^ Ralph L. Shriner, Christine K.F. Hermann, Terence C. Morrill, David Y. Curtin, Reynold C. Fuson «The Systematic Identification of Organic Compounds» 8th edition, J. Wiley, Hoboken. ISBN 0-471-21503-1
- ^ Saalwächter, Kay; Burchard, Walther; Klüfers, Peter; Kettenbach, G.; Mayer, Peter; Klemm, Dieter; Dugarmaa, Saran (2000). «Cellulose Solutions in Water Containing Metal Complexes». Macromolecules. 33 (11): 4094–4107. Bibcode:2000MaMol..33.4094S. CiteSeerX 10.1.1.951.5219. doi:10.1021/ma991893m.
- ^ Deodhar, S., Huckaby, J., Delahoussaye, M. and DeCoster, M.A., 2014, August. High-aspect ratio bio-metallic nanocomposites for cellular interactions. In IOP Conference Series: Materials Science and Engineering (Vol. 64, No. 1, p. 012014). https://iopscience.iop.org/article/10.1088/1757-899X/64/1/012014/meta.
- ^ Kelly, K.C., Wasserman, J.R., Deodhar, S., Huckaby, J. and DeCoster, M.A., 2015. Generation of scalable, metallic high-aspect ratio nanocomposites in a biological liquid medium. JoVE (Journal of Visualized Experiments), (101), p.e52901. https://www.jove.com/t/52901/generation-scalable-metallic-high-aspect-ratio-nanocomposites.
- ^ Karan, A., Darder, M., Kansakar, U., Norcross, Z. and DeCoster, M.A., 2018. Integration of a Copper-Containing Biohybrid (CuHARS) with Cellulose for Subsequent Degradation and Biomedical Control. International journal of environmental research and public health, 15(5), p.844. https://www.mdpi.com/1660-4601/15/5/844
- ^ «Modern Organocopper Chemistry» Norbert Krause, Ed., Wiley-VCH, Weinheim, 2002. ISBN 978-3-527-29773-3.
- ^ Berná, José; Goldup, Stephen; Lee, Ai-Lan; Leigh, David; Symes, Mark; Teobaldi, Gilberto; Zerbetto, Fransesco (26 May 2008). «Cadiot–Chodkiewicz Active Template Synthesis of Rotaxanes and Switchable Molecular Shuttles with Weak Intercomponent Interactions». Angewandte Chemie. 120 (23): 4464–4468. Bibcode:2008AngCh.120.4464B. doi:10.1002/ange.200800891.
- ^ Rafael Chinchilla & Carmen Nájera (2007). «The Sonogashira Reaction: A Booming Methodology in Synthetic Organic Chemistry». Chemical Reviews. 107 (3): 874–922. doi:10.1021/cr050992x. PMID 17305399.
- ^ «An Addition of an Ethylcopper Complex to 1-Octyne: (E)-5-Ethyl-1,4-Undecadiene» (PDF). Organic Syntheses. 64: 1. 1986. doi:10.15227/orgsyn.064.0001. Archived from the original (PDF) on 19 June 2012.
- ^ Kharasch, M.S.; Tawney, P.O. (1941). «Factors Determining the Course and Mechanisms of Grignard Reactions. II. The Effect of Metallic Compounds on the Reaction between Isophorone and Methylmagnesium Bromide». Journal of the American Chemical Society. 63 (9): 2308–2316. doi:10.1021/ja01854a005.
- ^ Imai, Sadako; Fujisawa, Kiyoshi; Kobayashi, Takako; Shirasawa, Nobuhiko; Fujii, Hiroshi; Yoshimura, Tetsuhiko; Kitajima, Nobumasa; Moro-oka, Yoshihiko (1998). «63Cu NMR Study of Copper(I) Carbonyl Complexes with Various Hydrotris(pyrazolyl)borates: Correlation between 63Cu Chemical Shifts and CO Stretching Vibrations». Inorganic Chemistry. 37 (12): 3066–3070. doi:10.1021/ic970138r.
- ^ G. Brauer, ed. (1963). «Potassium Cuprate (III)». Handbook of Preparative Inorganic Chemistry. Vol. 1 (2nd ed.). NY: Academic Press. p. 1015.
- ^ Schwesinger, Reinhard; Link, Reinhard; Wenzl, Peter; Kossek, Sebastian (2006). «Anhydrous phosphazenium fluorides as sources for extremely reactive fluoride ions in solution». Chemistry: A European Journal. 12 (2): 438–45. doi:10.1002/chem.200500838. PMID 16196062.
- ^ Lewis, E.A.; Tolman, W.B. (2004). «Reactivity of Dioxygen-Copper Systems». Chemical Reviews. 104 (2): 1047–1076. doi:10.1021/cr020633r. PMID 14871149.
- ^ McDonald, M.R.; Fredericks, F.C.; Margerum, D.W. (1997). «Characterization of Copper(III)–Tetrapeptide Complexes with Histidine as the Third Residue». Inorganic Chemistry. 36 (14): 3119–3124. doi:10.1021/ic9608713. PMID 11669966.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 1187. ISBN 978-0-08-037941-8.
- ^ A Timeline of Copper Technologies, Copper Development Association, https://www.copper.org/education/history/timeline/
- ^ a b «CSA – Discovery Guides, A Brief History of Copper». Csa.com. Archived from the original on 3 February 2015. Retrieved 12 September 2008.
- ^ Rayner W. Hesse (2007). Jewelrymaking through History: an Encyclopedia. Greenwood Publishing Group. p. 56. ISBN 978-0-313-33507-5.No primary source is given in that book.
- ^ «Copper». Elements.vanderkrogt.net. Retrieved 12 September 2008.
- ^ Renfrew, Colin (1990). Before civilization: the radiocarbon revolution and prehistoric Europe. Penguin. ISBN 978-0-14-013642-5. Retrieved 21 December 2011.
- ^ Cowen, R. «Essays on Geology, History, and People: Chapter 3: Fire and Metals». Retrieved 7 July 2009.
- ^ Timberlake, S. & Prag A.J.N.W. (2005). The Archaeology of Alderley Edge: Survey, excavation and experiment in an ancient mining landscape. Oxford: John and Erica Hedges Ltd. p. 396. doi:10.30861/9781841717159. ISBN 9781841717159.
- ^ a b «CSA – Discovery Guides, A Brief History of Copper». CSA Discovery Guides. Archived from the original on 3 February 2015. Retrieved 29 April 2011.
- ^ Pleger, Thomas C. «A Brief Introduction to the Old Copper Complex of the Western Great Lakes: 4000–1000 BC», Proceedings of the Twenty-Seventh Annual Meeting of the Forest History Association of Wisconsin, Oconto, Wisconsin, 5 October 2002, pp. 10–18.
- ^ Emerson, Thomas E. and McElrath, Dale L. Archaic Societies: Diversity and Complexity Across the Midcontinent, SUNY Press, 2009 ISBN 1-4384-2701-8.
- ^ Dainian, Fan. Chinese Studies in the History and Philosophy of Science and Technology. p. 228.
- ^ Wallach, Joel. Epigenetics: The Death of the Genetic Theory of Disease Transmission.
- ^ Radivojević, Miljana; Rehren, Thilo (December 2013). «Tainted ores and the rise of tin bronzes in Eurasia, c. 6500 years ago». Antiquity Publications Ltd.
- ^ a b McNeil, Ian (2002). Encyclopaedia of the History of Technology. London; New York: Routledge. pp. 13, 48–66. ISBN 978-0-203-19211-5.
- ^ Rickard, T.A. (1932). «The Nomenclature of Copper and its Alloys». Journal of the Royal Anthropological Institute. 62: 281–290. doi:10.2307/2843960. JSTOR 2843960.
- ^ Timberlake, Simon (11 June 2017). «New ideas on the exploitation of copper, tin, gold, and lead ores in Bronze Age Britain: The mining, smelting, and movement of metal». Materials and Manufacturing Processes. 32 (7–8): 709–727. doi:10.1080/10426914.2016.1221113. S2CID 138178474.
- ^ Martin, Susan R. (1995). «The State of Our Knowledge About Ancient Copper Mining in Michigan». The Michigan Archaeologist. 41 (2–3): 119. Archived from the original on 7 February 2016.
- ^ Hong, S.; Candelone, J.-P.; Patterson, C.C.; Boutron, C.F. (1996). «History of Ancient Copper Smelting Pollution During Roman and Medieval Times Recorded in Greenland Ice». Science. 272 (5259): 246–249 (247f.). Bibcode:1996Sci…272..246H. doi:10.1126/science.272.5259.246. S2CID 176767223.
- ^ de Callataÿ, François (2005). «The Graeco-Roman Economy in the Super Long-Run: Lead, Copper, and Shipwrecks». Journal of Roman Archaeology. 18: 361–372 (366–369). doi:10.1017/S104775940000742X. S2CID 232346123.
- ^ Savenije, Tom J.; Warman, John M.; Barentsen, Helma M.; van Dijk, Marinus; Zuilhof, Han; Sudhölter, Ernst J.R. (2000). «Corinthian Bronze and the Gold of the Alchemists» (PDF). Macromolecules. 33 (2): 60–66. Bibcode:2000MaMol..33…60S. doi:10.1021/ma9904870. Archived from the original (PDF) on 29 September 2007.
- ^ Lynch, Martin (2004). Mining in World History. p. 60. ISBN 978-1-86189-173-0.
- ^ «Gold: prices, facts, figures and research: A brief history of money». Retrieved 22 April 2011.
- ^ «Copper and Brass in Ships». Retrieved 6 September 2016.
- ^ Stelter, M.; Bombach, H. (2004). «Process Optimization in Copper Electrorefining». Advanced Engineering Materials. 6 (7): 558–562. doi:10.1002/adem.200400403. S2CID 138550311.
- ^ Gardner, E. D.; et al. (1938). Copper Mining in North America. Washington, D. C.: U. S. Bureau of Mines. Retrieved 19 March 2019.
- ^ Hyde, Charles (1998). Copper for America, the United States Copper Industry from Colonial Times to the 1990s. Tucson, Arizona: University of Arizona Press. p. passim. ISBN 0-8165-1817-3.
- ^ «Outokumpu Flash Smelting» (PDF). Outokumpu. p. 2. Archived from the original (PDF) on 24 July 2011.
- ^ Karen A. Mingst (1976). «Cooperation or illusion: an examination of the intergovernmental council of copper exporting countries». International Organization. 30 (2): 263–287. doi:10.1017/S0020818300018270. S2CID 154183817.
- ^ Ryck Lydecker. «Is Copper Bottom Paint Sinking?». BoatUS Magazine. Retrieved 3 June 2016.
- ^ «Copper». American Elements. 2008. Archived from the original on 8 June 2008. Retrieved 12 July 2008.
- ^ Pops, Horace, 2008, «Processing of wire from antiquity to the future», Wire Journal International, June, pp. 58–66
- ^ The Metallurgy of Copper Wire, http://www.litz-wire.com/pdf%20files/Metallurgy_Copper_Wire.pdf Archived 1 September 2013 at the Wayback Machine
- ^ Joseph, Günter, 1999, Copper: Its Trade, Manufacture, Use, and Environmental Status, edited by Kundig, Konrad J.A., ASM International, pp. 141–192 and pp. 331–375.
- ^ «Copper, Chemical Element – Overview, Discovery and naming, Physical properties, Chemical properties, Occurrence in nature, Isotopes». Chemistryexplained.com. Retrieved 16 October 2012.
- ^ Joseph, Günter, 1999, Copper: Its Trade, Manufacture, Use, and Environmental Status, edited by Kundig, Konrad J.A., ASM International, p.348
- ^ «Aluminum Wiring Hazards and Pre-Purchase Inspections». www.heimer.com. Archived from the original on 28 May 2016. Retrieved 3 June 2016.
- ^ «Accelerator: Waveguides (SLAC VVC)». SLAC Virtual Visitor Center. Retrieved 29 April 2011.
- ^ IE3 energy-saving motors, Engineer Live, http://www.engineerlive.com/Design-Engineer/Motors_and_Drives/IE3_energy-saving_motors/22687/
- ^ Energy‐efficiency policy opportunities for electric motor‐driven systems, International Energy Agency, 2011 Working Paper in the Energy Efficiency Series, by Paul Waide and Conrad U. Brunner, OECD/IEA 2011
- ^ Fuchsloch, J. and E.F. Brush, (2007), «Systematic Design Approach for a New Series of Ultra‐NEMA Premium Copper Rotor Motors», in EEMODS 2007 Conference Proceedings, 10–15 June, Beijing.
- ^ Copper motor rotor project; Copper Development Association; «Copper.org: Copper Motor Rotor Project». Archived from the original on 13 March 2012. Retrieved 7 November 2012.
- ^ NEMA Premium Motors, The Association of Electrical Equipment and Medical Imaging Manufacturers; «NEMA — NEMA Premium Motors». Archived from the original on 2 April 2010. Retrieved 12 October 2009.
- ^ International Energy Agency, IEA sees renewable energy growth accelerating over next 5 years, http://www.iea.org/newsroomandevents/pressreleases/2012/july/name,28200,en.html
- ^ Global trends in renewable energy investment 2012, by REN21 (Renewable Energy Policy Network for the 21st Century); http://www.ren21.net/gsr
- ^ Will the Transition to Renewable Energy Be Paved in Copper?, Renewable Energy World; Jan 15, 2016; https://www.renewableenergyworld.com/articles/2016/01/will-the-transition-to-renewable-energy-be-paved-in-copper.html Archived 2018-06-22 at the Wayback Machine
- ^ García-Olivares, Antonio, Joaquim Ballabrera-Poy, Emili García-Ladona, and Antonio Turiel. A global renewable mix with proven technologies and common materials, Energy Policy, 41 (2012): 561-57, http://imedea.uib-csic.es/master/cambioglobal/Modulo_I_cod101601/Ballabrera_Diciembre_2011/Articulos/Garcia-Olivares.2011.pdf
- ^ A kilo more of copper increases environmental performance by 100 to 1,000 times; Renewable Energy Magazine; April 14, 2011; http://www.renewableenergymagazine.com/article/a-kilo-more-of-copper-increases-environmental
- ^ Copper at the core of renewable energies; European Copper Institute; European Copper Institute; 18 pages; http://www.eurocopper.org/files/presskit/press_kit_copper_in_renewables_final_29_10_2008.pdf Archived 2012-05-23 at the Wayback Machine
- ^ Copper in energy systems; Copper Development Association Inc.; http://www.copper.org/environment/green/energy.html
- ^ The Rise Of Solar: A Unique Opportunity For Copper; Solar Industry Magazine; April 2017; Zolaika Strong; https://issues.solarindustrymag.com/article/rise-solar-unique-opportunity-copper
- ^ Pops, Horace, 1995. Physical Metallurgy of Electrical Conductors, in Nonferrous Wire Handbook, Volume 3: Principles and Practice, The Wire Association International
- ^ The World Copper Factbook, 2017; http://www.icsg.org/index.php/component/jdownloads/finish/170/2462
- ^ Copper Mineral Commodity Summary (USGS, 2017) https://minerals.usgs.gov/minerals/pubs/commodity/copper/ mcs-2017-coppe.pdf
- ^ Global Mineral Resource Assessment (USGS, 2014) http://pubs.usgs.gov/fs/2014/3004/pdf/fs2014-3004.pdf
- ^ Long-Term Availability of Copper; International Copper Association; http://copperalliance.org/wordpress/wp-content/uploads/2018/02/ICA-long-term-availability-201802-A4-HR.pdf Archived 2018-06-29 at the Wayback Machine
- ^ Will the Transition to Renewable Energy Be Paved in Copper?, Renewable Energy World; Jan 15, 2016; by Zolaikha Strong; https://www.renewableenergyworld.com/articles/2016/01/will-the-transition-to-renewable-energy-be-paved-in-copper.html Archived 2018-06-22 at the Wayback Machine
- ^ Seale, Wayne (2007). The role of copper, brass, and bronze in architecture and design; Metal Architecture, May 2007
- ^ Copper roofing in detail; Copper in Architecture; Copper Development Association, U.K., www.cda.org.uk/arch
- ^ Architecture, European Copper Institute; http://eurocopper.org/copper/copper-architecture.html Archived 9 October 2012 at the Wayback Machine
- ^ Kronborg completed; Agency for Palaces and Cultural Properties, København, «Kronborg completed — Agency for Palaces and Cultural Properties». Archived from the original on 24 October 2012. Retrieved 12 September 2012.
- ^ Berg, Jan. «Why did we paint the library’s roof?». Archived from the original on 25 June 2007. Retrieved 20 September 2007.
- ^ Architectural considerations; Copper in Architecture Design Handbook, http://www.copper.org/applications/architecture/arch_dhb/fundamentals/arch_considerations.htm[permanent dead link]
- ^ Peters, Larry E. (2004). Preventing corrosion on copper roofing systems; Professional Roofing, October 2004, http://www.professionalroofing.net
- ^ Oxidation Reaction: Why is the Statue of Liberty Blue-Green? Engage Students in Engineering; www.EngageEngineering.org; Chun Wu, PhD, Mount Marty College; Funded by the National Science Foundation (NSF) under Grant No. 083306. «Archived copy» (PDF). Archived from the original (PDF) on 25 October 2013. Retrieved 25 October 2013.
{{cite web}}: CS1 maint: archived copy as title (link) - ^ Fitzgerald, K.P.; Nairn, J.; Atrens, A. (1998). «The chemistry of copper patination». Corrosion Science. 40 (12): 2029–50. doi:10.1016/S0010-938X(98)00093-6.
- ^ Application Areas: Architecture – Finishes – patina; http://www.copper.org/applications/architecture/finishes.html
- ^ Glossary of copper terms, Copper Development Association (UK): «Glossary of copper terms». Archived from the original on 20 August 2012. Retrieved 14 September 2012.
- ^ Finishes – natural weathering; Copper in Architecture Design Handbook, Copper Development Association Inc., «Copper.org: Architecture Design Handbook: Finishes». Archived from the original on 16 October 2012. Retrieved 12 September 2012.
- ^ Davis, Joseph R. (2001). Copper and Copper Alloys. ASM International. pp. 3–6, 266. ISBN 978-0-87170-726-0.
- ^ Edding, Mario E., Flores, Hector, and Miranda, Claudio, (1995), Experimental Usage of Copper-Nickel Alloy Mesh in Mariculture. Part 1: Feasibility of usage in a temperate zone; Part 2: Demonstration of usage in a cold zone; Final report to the International Copper Association Ltd.
- ^ Corrosion Behaviour of Copper Alloys used in Marine Aquaculture Archived 24 September 2013 at the Wayback Machine. (PDF) . copper.org. Retrieved on 8 November 2011.
- ^ Copper Touch Surfaces Archived 23 July 2012 at the Wayback Machine. Copper Touch Surfaces. Retrieved on 8 November 2011.
- ^ «EPA Registers Copper Surfaces for Residual Use Against Coronavirus». United States Environmental Protection Agency. 10 February 2021. Retrieved 11 October 2021.
- ^ Montero, David A.; Arellano, Carolina; Pardo, Mirka; Vera, Rosa; Gálvez, Ricardo; Cifuentes, Marcela; Berasain, María A.; Gómez, Marisol; Ramírez, Claudio; Vidal, Roberto M. (5 January 2019). «Antimicrobial properties of a novel copper-based composite coating with potential for use in healthcare facilities». Antimicrobial Resistance and Infection Control. 8 (1): 3. doi:10.1186/s13756-018-0456-4. ISSN 2047-2994. PMC 6321648. PMID 30627427.
- ^ a b «EPA registers copper-containing alloy products». United States Environmental Protection Agency. May 2008. Archived from the original on 29 September 2015.
- ^ Biurrun, Amaya; Caballero, Luis; Pelaz, Carmen; León, Elena; Gago, Alberto (1999). «Treatment of a Legionella pneumophila‐Colonized Water Distribution System Using Copper‐Silver Ionization and Continuous Chlorination» (PDF). Infection Control and Hospital Epidemiology. 20 (6): 426–428. doi:10.1086/501645. JSTOR 30141645. PMID 10395146. S2CID 32388649. Archived from the original (PDF) on 17 February 2019.
- ^ Zaleski, Andrew, As hospitals look to prevent infections, a chorus of researchers make a case for copper surfaces, STAT, 24 September 2020
- ^ Chilean subway protected with Antimicrobial Copper – Rail News from Archived 24 July 2012 at the Wayback Machine. rail.co. Retrieved on 8 November 2011.
- ^ Codelco to provide antimicrobial copper for new metro lines (Chile)[dead link]. Construpages.com.ve. Retrieved on 8 November 2011.
- ^ PR 811 Chilean Subway Installs Antimicrobial Copper Archived 23 November 2011 at the Wayback Machine. (PDF). antimicrobialcopper.com. Retrieved on 8 November 2011.
- ^ «Copper and Cupron». Cupron.
- ^ «Global copper market under supplied, demand on the rise – report». Mining.com. 6 January 2019. Retrieved 13 January 2019.
- ^ «Will the Transition to Renewable Energy Be Paved in Copper?». www.renewableenergyworld.com. 15 January 2015. Archived from the original on 22 June 2018. Retrieved 13 January 2019.
- ^ «Copper and cars: Boom goes beyond electric vehicles». MINING.com. 18 June 2018. Retrieved 13 January 2019.
- ^ «Impact of electric cars in medium-term copper demand ‘overrated’, experts say». MINING.com. 12 April 2018. Retrieved 13 January 2019.
- ^ «Why are Premiums for Copper Bullion So High?». Provident Metals. 20 August 2012. Retrieved 23 January 2019.
- ^ Chace, Zoe. «Penny Hoarders Hope for the Day The Penny Dies». NPR.org. NPR. Retrieved 23 January 2019.
- ^ Walker, W.R.; Keats, D.M. (1976). «An investigation of the therapeutic value of the ‘copper bracelet’-dermal assimilation of copper in arthritic/rheumatoid conditions». Agents and Actions. 6 (4): 454–459. PMID 961545.
- ^ Richmond SJ, Gunadasa S, Bland M, Macpherson H (2013). «Copper bracelets and magnetic wrist straps for rheumatoid arthritis – analgesic and anti-inflammatory effects: a randomised double-blind placebo controlled crossover trial». PLOS ONE. 8 (9): e71529. Bibcode:2013PLoSO…871529R. doi:10.1371/journal.pone.0071529. PMC 3774818. PMID 24066023.
- ^ Richmond, Stewart J.; Brown, Sally R.; Campion, Peter D.; Porter, Amanda J.L.; Moffett, Jennifer A. Klaber; Jackson, David A.; Featherstone, Valerie A.; Taylor, Andrew J. (2009). «Therapeutic effects of magnetic and copper bracelets in osteoarthritis: A randomised placebo-controlled crossover trial». Complementary Therapies in Medicine. 17 (5–6): 249–256. doi:10.1016/j.ctim.2009.07.002. ISSN 0965-2299. PMID 19942103.
- ^ University of Arkansas for Medical Sciences:
Find the Truth Behind Medical Myths Archived 6 January 2014 at the Wayback MachineWhile it’s never been proven that copper can be absorbed through the skin by wearing a bracelet, research has shown that excessive copper can result in poisoning, causing vomiting and, in severe cases, liver damage.
- ^
Truth in Advertising
Tommie Copper - ^ a b Geoffrey Michael Gadd (March 2010). «Metals, minerals and microbes: geomicrobiology and bioremediation». Microbiology. 156 (3): 609–643. doi:10.1099/mic.0.037143-0. PMID 20019082.
- ^ Harbhajan Singh (2006). Mycoremediation: Fungal Bioremediation. p. 509. ISBN 978-0-470-05058-3.
- ^ Vest, Katherine E.; Hashemi, Hayaa F.; Cobine, Paul A. (2013). «Chapter 13 The Copper Metallome in Eukaryotic Cells». In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 451–78. doi:10.1007/978-94-007-5561-1_13. ISBN 978-94-007-5560-4. PMID 23595680. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402
- ^ «Fun facts». Horseshoe crab. University of Delaware. Archived from the original on 22 October 2008. Retrieved 13 July 2008.
- ^ a b S.J. Lippard, J.M. Berg «Principles of bioinorganic chemistry» University Science Books: Mill Valley, CA; 1994. ISBN 0-935702-73-3.
- ^ Decker, H. & Terwilliger, N. (2000). «COPs and Robbers: Putative evolution of copper oxygen-binding proteins». Journal of Experimental Biology. 203 (Pt 12): 1777–1782. doi:10.1242/jeb.203.12.1777. PMID 10821735.
- ^
Schneider, Lisa K.; Wüst, Anja; Pomowski, Anja; Zhang, Lin; Einsle, Oliver (2014). «Chapter 8. No Laughing Matter: The Unmaking of the Greenhouse Gas Dinitrogen Monoxide by Nitrous Oxide Reductase«. In Peter M.H. Kroneck; Martha E. Sosa Torres (eds.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 177–210. doi:10.1007/978-94-017-9269-1_8. ISBN 978-94-017-9268-4. PMID 25416395. - ^ Denoyer, Delphine; Clatworthy, Sharnel A.S.; Cater, Michael A. (2018). «Chapter 16. Copper Complexes in Cancer Therapy». In Sigel, Astrid; Sigel, Helmut; Freisinger, Eva; Sigel, Roland K.O. (eds.). Metallo-Drugs: Development and Action of Anticancer Agents. Metal Ions in Life Sciences. Vol. 18. Berlin: de Gruyter GmbH. pp. 469–506. doi:10.1515/9783110470734-022. ISBN 978-3-11-047073-4. PMID 29394035.
- ^ a b «Amount of copper in the normal human body, and other nutritional copper facts». Archived from the original on 10 April 2009. Retrieved 3 April 2009.
- ^ Adelstein, S. J.; Vallee, B. L. (1961). «Copper metabolism in man». New England Journal of Medicine. 265 (18): 892–897. doi:10.1056/NEJM196111022651806. PMID 13859394.
- ^ M.C. Linder; Wooten, L.; Cerveza, P.; Cotton, S.; Shulze, R.; Lomeli, N. (1 May 1998). «Copper transport». The American Journal of Clinical Nutrition. 67 (5): 965S–971S. doi:10.1093/ajcn/67.5.965S. PMID 9587137.
- ^ Frieden, E.; Hsieh, H.S. (1976). Ceruloplasmin: The copper transport protein with essential oxidase activity. Advances in Enzymology – and Related Areas of Molecular Biology. Vol. 44. pp. 187–236. doi:10.1002/9780470122891.ch6. ISBN 978-0-470-12289-1. JSTOR 20170553. PMID 775938.
- ^ S.S. Percival; Harris, E.D. (1 January 1990). «Copper transport from ceruloplasmin: Characterization of the cellular uptake mechanism». American Journal of Physiology. Cell Physiology. 258 (1): C140–C146. doi:10.1152/ajpcell.1990.258.1.c140. PMID 2301561.
- ^ Dietary Reference Intakes: RDA and AI for Vitamins and Elements Archived 13 November 2018 at the Wayback Machine Food and Nutrition Board, Institute of Medicine, National Academies Press, 2011. Retrieved 18 April 2018.
- ^ Copper. IN: Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Copper. National Academy Press. 2001, PP. 224–257.
- ^ «Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies» (PDF). 2017.
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006
- ^ «Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR p. 33982» (PDF).
- ^ «Daily Value Reference of the Dietary Supplement Label Database (DSLD)». Dietary Supplement Label Database (DSLD). Archived from the original on 7 April 2020. Retrieved 16 May 2020.
- ^ Bonham, Maxine; O’Connor, Jacqueline M.; Hannigan, Bernadette M.; Strain, J.J. (2002). «The immune system as a physiological indicator of marginal copper status?». British Journal of Nutrition. 87 (5): 393–403. doi:10.1079/BJN2002558. PMID 12010579.
- ^ Li, Yunbo; Trush, Michael; Yager, James (1994). «DNA damage caused by reactive oxygen species originating from a copper-dependent oxidation of the 2-hydroxy catechol of estradiol». Carcinogenesis. 15 (7): 1421–1427. doi:10.1093/carcin/15.7.1421. PMID 8033320.
- ^ Gordon, Starkebaum; John, M. Harlan (April 1986). «Endothelial cell injury due to copper-catalyzed hydrogen peroxide generation from homocysteine». J. Clin. Invest. 77 (4): 1370–6. doi:10.1172/JCI112442. PMC 424498. PMID 3514679.
- ^ «Pesticide Information Profile for Copper Sulfate». Cornell University. Retrieved 10 July 2008.
- ^ Hunt, Charles E. & William W. Carlton (1965). «Cardiovascular Lesions Associated with Experimental Copper Deficiency in the Rabbit». Journal of Nutrition. 87 (4): 385–394. doi:10.1093/jn/87.4.385. PMID 5841854.
- ^ Ayyat M.S.; Marai I.F.M.; Alazab A.M. (1995). «Copper-Protein Nutrition of New Zealand White Rabbits under Egyptian Conditions». World Rabbit Science. 3 (3): 113–118. doi:10.4995/wrs.1995.249.
- ^ Brewer GJ (March 2012). «Copper excess, zinc deficiency, and cognition loss in Alzheimer’s disease». BioFactors (Review). 38 (2): 107–113. doi:10.1002/biof.1005. hdl:2027.42/90519. PMID 22438177. S2CID 16989047.
- ^ «Copper: Alzheimer’s Disease». Examine.com. Retrieved 21 June 2015.
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0151». National Institute for Occupational Safety and Health (NIOSH).
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0150». National Institute for Occupational Safety and Health (NIOSH).
- ^ OEHHA Copper
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). «Hazardous Compounds in Tobacco Smoke». International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207.
- ^ Pourkhabbaz, A.; Pourkhabbaz, H. (2012). «Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues». Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865. PMID 23493960.
- ^ Bernhard, David; Rossmann, Andrea; Wick, Georg (2005). «Metals in cigarette smoke». IUBMB Life. 57 (12): 805–809. doi:10.1080/15216540500459667. PMID 16393783. S2CID 35694266.
Notes
|
|
|
|
|
| in pure water, or acidic or alkali conditions. Copper in neutral water is more noble than hydrogen. | in water containing sulfide | in 10 M ammonia solution | in a chloride solution |
Further reading
- Massaro, Edward J., ed. (2002). Handbook of Copper Pharmacology and Toxicology. Humana Press. ISBN 978-0-89603-943-8.
- «Copper: Technology & Competitiveness (Summary) Chapter 6: Copper Production Technology» (PDF). Office of Technology Assessment. 2005.
- Current Medicinal Chemistry, Volume 12, Number 10, May 2005, pp. 1161–1208(48) Metals, Toxicity and Oxidative Stress
- William D. Callister (2003). Materials Science and Engineering: an Introduction (6th ed.). Wiley, New York. Table 6.1, p. 137. ISBN 978-0-471-73696-7.
- Material: Copper (Cu), bulk, MEMS and Nanotechnology Clearinghouse.
- Kim BE; Nevitt T; Thiele DJ (2008). «Mechanisms for copper acquisition, distribution and regulation». Nat. Chem. Biol. 4 (3): 176–85. doi:10.1038/nchembio.72. PMID 18277979.
External links
Wikiquote has quotations related to Copper.
Wikimedia Commons has media related to Copper.
Look up copper in Wiktionary, the free dictionary.
Wikisource has original text related to this article:
- Copper at The Periodic Table of Videos (University of Nottingham)
- Copper and compounds fact sheet from the National Pollutant Inventory of Australia
- Copper.org – official website of the Copper Development Association with an extensive site of properties and uses of copper
- Price history of copper, according to the IMF
(лат. Cuprum-от назв. о. Кипр, где в древности добывали медную руду) Сu, хим. элемент I гр. периодич. системы, ат. н. 29, ат. м. 63,546. Прир. М. состоит из смеси двух стабильных изотопов 63 Сu (69,09%) и 65 Сu (30,91%). Поперечное сечение захвата тепловых нейтронов для прир. смеси 3,77.10-28 м 2. Конфигурация внеш. электронной оболочки атома 3d104s1; степени окисления + 1, +2, редко +3, + 4; энергии ионизации Сu0


Содержание М. в земной коре (4,7.5,5).10-3% по массе. Для М. характерны месторождения гидротермального происхождения. В морской воде содержание М. 3.10-7% по массе, в речной Ч1.10-7%; ионы М., поступающие в бассейны морей и океанов, сорбируются донными отложениями, поэтому содержание М. в них достигает 5,7.10-3%. Ионы М. участвуют во многих физиол. процессах, среднее содержание М. в живых организмах 2.10-4% по массе, в крови человека ок. 0,001 мг/л.
В земной коре М. встречается в осн. в виде соед. с S (св. 90% мировых запасов и добычи М.) и в виде кислородсодержащих соединений. Среди многочисл. минералов М. (более 250) наиб. важны: халькопирит CuFeS2, ковеллин CuS, халькозин Cu2S, борнит Cu5FeS4, куприт Сu2 О, малахит CuCO3.Cu(OH)2, хризоколла CuSiO3.2H2O др. Редко встречается самородная М. Медные руды по минера-логич. составу м. б. подразделены на сульфидные, оксидные и смешанные (30-40% Си в форме оксидных минералов). По текстурным особенностям различают медные руды массивные, или сплошные (колчеданные, медно-никелевые, по-лиметаллич.), и прожилково-вкрапленные (медистые песчаники и сланцы). Медные руды полиметаллич., помимо М., они содержат Fe, Zn, Pb, Ni, Au, Ag, Mo, Re, Se, Fe, платиновые металлы и др. Осн. мировые запасы М. (кроме СССР) сосредоточены в Сев. Америке (США, Канада, Мексика)-32%, Юж. Америке (Чили, Перу)-30%, Африке (Замбия, Заир)-15%. Мировые запасы медных руд (без СССР) составляют 847,6 млн. т, в т. ч. доказанные 447,4 млн. т.
Свойства. М.-пластичный, розовато-красный металл с характерным металлич. блеском, тонкие пленки М. при просвечивании-зеленовато-голубого цвета. Кристаллич. решетка гранецентрированная кубич., а = 0,36150 нм, 2 = 4, пространств. группа Fт З т. Т. пл. 1083,4 0 С, т. кип. 2567 °С; плотн. 8,92 г/см 3, жидкой при 1100 0 С-8,36 г/см 3, при 200°С-8,32 г/см 3, рентгеновская плотн. 8,9331 г/см 3; C0 р 24,44 ДжДмоль Х К), ур-ние температурной зависимости в интервале 248-1356,9 К: С 0 р = >4,187(5,41 + 1,4.7.10-3 Т)ДжДмоль . К); DH0 пл 13,02 кДж/моль, скрытая DH пл 205 кДж/молъ, DH0 исп 304,8 кДж/моль; 0298 33,15 ДжДмоль . К); ур-ние температурной зависимости давления пара над жидкой М.: lgp(Па) = -17650/T + 1 l,27.l,273lg Т(1356,9-2870 К). Даже при 1900 К давление пара над М. не превышает 133,32 Па. Температурный коэф. линейного расширения 1,7.10-5 К -1 (273-323 К), ур-ние температурной зависимости линейного расширения: t = l0(1 + 1,67.10-5t + +>3,8.10-9t2 + 1,5.10-12t3) м, где l0 -длина образца при 25 °С; объемная усадка при кристаллизации-4,1%. Наиб. важные и широко используемые св-ва М.-ее высокая теплопроводность и малое электрич. сопротивление:

Температурный коэф. r 4,3-10~3 К -1 (273-373 К). М. диамагнитна, уд. магн. восприимчивость -0,66.10-6. Для жидкой М. у (в мН/м): 1120 (1413 К), 1160 (1473 К), 1226 (1573 К); h (в мПа . с): 4,0 (1356,9 К), 8,6 (1373 К), 3,41 (1418 К).
М.-мягкий, ковкий металл; твердость по Моосу 3,0; твердость по Бринеллю 370-420 МПа; s раст 220 МПа; относит. удлинение 60%, относит. уменьшение поперечного сечения 70%; модуль продольной упругости 112 ГПа; модуль сдвига 49,25 ГПа; коэф. Пуассона 0,34. После обработки давлением в связи с наклепом предел прочности М. возрастает до 400-450 МПа, уменьшаются на 1-3% удлинение и электрич. проводимость; последствия наклепа устраняются после отжига металла при 900-1000 К. Под действием нейтронного облучения (373 К, поток 5.1019 n/см 2) предел текучести М. возрастает почти в 2,7 раза, сопротивление разрыву-в 1,26 раза, удлинение уменьшается в 1,35 раза. Небольшие примеси Bi, Pb вызывают красноломкость М., S, О 2 — хладноломкость, примеси Р, As, Al, Fe заметно уменьшают электрич. проводимость М.
М. растворяет Н 2, к-рый существенно ухудшает ее мех. св-ва («водородная болезнь»). Р-римость Н 2 при 0,1 МПа (в см 3 на 1 кг М.):

Стандартный электродный потенциал для р-ции Сu2+ + + 2е 



М. не реагирует с Н 2, N2, С, Si. При пропускании NH3 над раскаленной М. образуется Cu3N, в аналогичных условиях при контакте с парами S, Se, H2S, оксидами азота на пов-сти М. образуются соотв. сульфиды, селениды, оксиды. При сплавлении с S М. дает Cu2S, с Se и Те -соотв. селениды и теллуриды. М. активно реагирует с галогенами, образуя соответствующие соли (см. Меди хлориды). С соляной к-той, разб. H2SO4, СН 3 СООН M. взаимод. только в присут. окислителей, образуя соответствующие соли Cu(II). В HNO3
М. раств. с образованием Cu(NO3)2 и оксидов азота, в горячей конц. H2SO4-c образованием CuSO4 и SO2 ,в конц. р-рах цианидов — давая комплекс состава [Cu(CN)2]—.
Соли Cu(I) бесцв., практически не раств. в воде, легко окисляются; Cu(I) склонна к диспропорционированию: 2Cu+ 
Соли Cu(I) и Cu(II) с рядом молекул и ионов (NH3, CN—, Сl— и др.) образуют устойчивые комплексные соед., напр. (NH4)2[CuBr3], K3[Cu(CN)4], K2[CuCl4], аммиакаты; коор-динац. числа для Сu(I)-2, 3, 4, для Сu(II)-3, 4, 6. Путем образования комплексных соед. можно перевести в р-р многие нерастворимые соли М. Известны соед. Cu(III)- неустойчивые, сильные окислители, примеры-KCuO2, K3[CuF6]. Наиб. важным соед. М. посвящены отдельные статьи, см., напр., Меди ацетаты, Меди нитрат, Меди сульфат, Медь-органические соединения.
Получение. Осн. сырье для получения М.-сульфидные, реже-смешанные руды. Большое значение приобретает переработка вторичного сырья, из к-рого в ряде развитых стран получают до 30-60% производимой М. В связи с невысоким содержанием М. в рудах (0,5-1,2%) и их много-компонентностью руды подвергают флотационному обогащению, получая попутно, помимо медного, и др. концентраты, напр. цинковый, никелевый, молибденовый, пиритный, свинцовый. Содержание М. в медных концентратах достигает 18-45%.
Осн. кол-во М. (85-88%) получают по пирометаллургич. схемам, к-рые, как правило, включают след. последовательные стадии: обжиг концентрата, плавку, конвертирование, рафинирование. Обжиг проводят при переработке высокосернистых и полиметаллич. концентратов. При обжиге удаляют избыточное кол-во S в форме газов, содержащих 5-8% SO2 и используемых для произ-ва H2SO4, и переводят часть примесей (Fe, Zn, As, Pb и др.) в формы, переходящие при послед. плавке в шлак. Обжиг проводят в печах «кипящего слоя» с применением дутья, обогащенного О 2 (24-26% О 2), без затрат углеродистого топлива. Продукт обжига — огарок -плавят в печах отражательного типа, реже — электропечах. Богатые М. руды плавили в шахтных печах, в настоящее время этот способ имеет подчиненное значение. Перечисл. способы плавки связаны с расходом (10-18% от массы шихты) углеродистого топлива (прир. газ, мазут, кокс) или электроэнергии (350-450 кВт . ч на 1 т шихты).
В процессе плавки образуются 2 жидкие фазы-сплав сульфидов М., Fe, цветных металлов (штейн; 22-45% Сu) и сплав оксидов металлов и силикатов (шлак; 0,4-0,7% Сu), к-рые не смешиваются друг с другом. Шлаки складируют или используют при произ-ве строит. материалов. Осваиваются автогенные процессы плавки, использующие тепло экзотермич. р-ций окисления сульфидов; концентраты обрабатывают в атмосфере О 2, воздуха, обогащенного О 2, или подогретого воздуха. Высокая производительность, получение богатых М. штейнов (до 75% Сu) и концентрированных по SO2 газов, миним. расход углеродистого топлива-достоинства, определяющие автогенные процессы как перспективное направление в развитии пирометаллургии М. Важнейшие способы автогенной плавки-кислородно-факельная, взвешенная, отражательная, электроплавка, плавка в жидкой ванне, процессы «Норанда», «Мицубиси».
Расплав штейна (в осн. Cu2S Х FeS) направляют на кон-вертирование — продувку сжатым воздухом с целью количеств. окисления FeS и его ошлакования в присут. кварцевого флюса (первая стадия процесса), окисления Cu2S и макс. удаления S и большинства примесей (вторая стадия):

При конвертировании используют тепло экзотермических р-ций окисления, конечный продукт-черновая М. (98,5-99,3% Сu).
Черновую М. рафинируют огневым, а затем электрохим. способом. Огневое рафинирование основано на большем, чем у М., сродстве большинства металлов-примесей к кислороду, что позволяет при продувке расплава воздухом окислить и ошлаковать количественно Fe, S, Zn, Pb и, частично, Ni, As, Sb, Bi. Для удаления кислорода расплав М. обрабатывают восстановителем (прир. конверсир. газ, сырая древесина). Готовый металл (>=99,5% Сu) разливают в формы, удобные для проведения электролиза. Полученные отливки служат анодами. Электролитич. рафинирование проводят в сернокислых р-рах при наложении постоянного тока; в процессе электролиза осуществляется непрерывная циркуляция подогреваемого (57-67°С) р-ра, М. осаждают на катодных основах, получаемых также электролизом в спец. матричных ваннах при условиях, обеспечивающих осаждение чистого металла. Для получения ровного катодного осадка требуемой текстуры в электролит вводят ПАВ. Катодную М. (>=99,94% Сu) переплавляют и разливают в формы, удобные для послед. обработки прокаткой, волочением. При растворении анодов ряд примесей (As, Fe, Ni, Sb) накапливается в электролите, поэтому часть его выводят из циркуляц. цикла (заменяя равным объемом р-ра H2SO4) и направляют на переработку для получения техн. сортов медного и никелевого купоросов. Нерастворимые включения анода образуют дисперсный продукт — шлам, в к-ром концентрируются благородные и редкие металлы. Этот продукт специально перерабатывают в шламовом цикле. Анодные остатки (выход их 15-18% от массы анода) возвращают на переплавку в цикл огневого рафинирования.
При пирометаллургич. переработке медного концентрата извлекают до 96-98% М. и благородных металлов, однако степень извлечения сопутствующих элементов (S, Zn, Ni, Pb) гораздо ниже, a Fe полностью теряется со шлаком.
Многие проблемы пирометаллургич. произ-ва М. (экологическая из-за повыш. тепло-, пыле- и газовыделения, взры-воопасность в случае контакта расплава штейна с водой и др.) устраняются при использовании гидрометаллургич. технологии. Она включает: селективное выщелачивание М. из сырья, чаще всего р-ром H2SO4 или NH3; очистку р-ра от примесей и извлечение сопутствующих ценных элементов (Zn, Co, Ni, Cd и др.); выделение М. При переработке бедных р-ров (0,5-12,0 г/л М.) используют цементацию на железном скрапе и экстракцию с послед. электрохим. осаждением М. Из богатых р-ров (30-40 г/л М.) М. извлекают чаще электролизом или автоклавным осаждением водородом (127-197 °С, давление Н 2 1,5-2,5 МПа). В последнем случае М. получают в форме порошка (>=99,6% М.). Гидрометаллургич. схемы эффективны при извлечении М. из бедных руд методами подземного, кучного, чанового выщелачивания, в т. ч. с использованием биохим. окисления сульфидов; остатки от выщелачивания смешанных руд обогащают флотацией. Рациональна переработка полиметаллич. концентратов, вторичного сырья, особенно при небольшом объеме произ-ва. В этом случае весьма перспективно автоклавное выщелачивание при повыш. т-рах (137-197 °С) и давлении кислородсодержащего газа-окислителя (давление О 2 0,2-1,0 МПа), обеспечивающее значит. интенсификацию процесса, получение более чистых р-ров и элементной S при окислении сульфидов. Гидрометаллургич. схемы позволяют более комплексно использовать сырье, проще обеспечить экологич. и пром. санитарию. Внедрение их сдерживается из-за недостаточной интенсивности, повыш. эксплуатац. затрат и др.
Определение. Соед. М. в смеси с содой и углем в пламени горелки образуют красный металлич. королек, р-римый в HNO3. Р-ры, содержащие ионы Сu2+ , при добавлении NH3 приобретают синюю окраску (чувствительность 0,007 мг/л); при добавлении K4[Fe(CN)6] выпадает красно-коричневый осадок (чувствительность 0,0001 мг/л); при взаимод. с Na2S или (NH4)2S образуется черный осадок CuS. Для количеств. определения М. используют гравиметрич., объемный, комплексонометрич., амперометрич., кондуктометрич., по-лярографич., потенциометрич., радиоактивац., эмиссионный, спектральный методы анализа. При повыш. содержании М. ее определяют объемным иодометрич. или более точным электрогравиметрич. методом. Для определения малых кол-в М. используют фотометрич. метод с дити-зоном, купфероном, диэтилдитиокарбаматом Na (чувствительность 0,02-0,002 мг/л), атомно-абсорбционный (кислородно-водородное пламя, l = 324,7 нм, чувствительность 0,01-0,0015 мг/л). При определении содержания М. в сточных водах дополнительно используют флуоресцентный (чувствительность 0,002 мг/л), спектральный (0,002-0,003 мг/л), хроматографич. (0,07 мг/л) методы анализа.
Применение. Широкое применение М. в пром-сти обусловлено рядом ее ценных св-в и прежде всего высокой электрич. проводимостью, пластичностью, теплопроводностью. Более 50% М. используется для изготовления проводов, кабелей, шин, токопроводящих частей электрич. установок. Из М. изготовляют теплообменную аппаратуру (вакуум-испарители, подогреватели, холодильники). Более 30% М. применяют в виде сплавов, важнейшие из к-рых — бронзы, латуни, мельхиор и др. (см. Меди сплавы). М. и ее сплавы используют также для изготовления художеств. изделий. В виде фольги М. применяют в радиоэлектронике. Значит. кол-во М. (10-12%) применяют в виде разл. соед. в медицине (антисептич. и вяжущие ср-ва), для изготовления инсектофунгицидов, в качестве медных удобрений, пигментов, катализаторов, в гальванотехнике и т. д.
Мировое произ-во М. (без СССР) ок. 7,5 млн. т, в т. ч. из вторичного сырья-1,15 млн. т/год (1985). Осн. страны-производители рафинированной М. (1985): США (1,7 млн. т), Япония (1,1), Чили (0,9), Канада (0,8), Замбия (0,53), Заир (0,5).
Все соли М. ядовиты; раздражают слизистые, поражают желудочно-кишечный тракт, вызывают тошноту, рвоту, заболевание печени и др. При вдыхании пыли М. развивается хронич. отравление. ПДК для аэрозолей М. 1 мг/м 3, питьевой воды 1,0 мг/л, для рыбных водоемов 0,01 мг/л, в сточных водах до биол. очистки 0,5 мг/л.
М. известна человечеству с глубокой древности. М. и ее сплавы сыграли заметную роль в развитии цивилизации.
Лит.: Набойченко С. С., Смирнов В. И., Гидрометаллургия меди, М., 1974; Металлургия меди, никеля, кобальта, 2 изд., ч. 1, М., 1977; Онаев И. А., Жакибаев Б. К., Медь в истории цивилизации, А.-А., 1983; Ванюков А. В., Уткин Н. И., Комплексная переработка медного и никелевого сырья, М., 1988; Ванюков А. В. [и др.], Плавка в жидкой ванне, М., 1988; Подчайно-ва В. Н., Симонова Л. Н., Медь, М., 1990. С. С. Набойченко.
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
Медь
1. Положение меди в периодической системе химических элементов
2. Электронное строение меди
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
Оксид меди (II)
- Способы получения
- Химические свойства
Оксид меди (I)
- Химические свойства
Гидроксид меди (II)
- Химические свойства
Соли меди
Медь
Положение в периодической системе химических элементов
Медь расположена в 11 группе (или в побочной подгруппе II группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии:
+29Cu 1s22s22p63s23p63d104s1 1s 2s
2p
3s 3p
4s
3d
У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Изображение с портала zen.yandex.com/media/id/5d426107ae56cc00ad977411/uralskaia-boginia-liubvi-5d6bcceda660d700b075a12d
Температура плавления 1083,4оС, температура кипения 2567оС, плотность меди 8,92 г/см3.
Медь — ценный металл в сфере вторичной переработки. Сдав лом меди в пункт приема, Вы можете получить хорошее денежное вознаграждение. Подробнее про прием лома меди.
Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2(OH)2CO3. Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн.
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
- Гидрометаллургический метод: растворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например, вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
Видеоопыт взаимодействия сульфата меди (II) с железом можно посмотреть здесь.
- Пирометаллургический метод: получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций. Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
- Электролиз растворов солей меди:
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами. При этом образуется голубой осадок гидроксида меди(II).
Например, сульфат меди (II) взаимодействует с гидроксидом натрия:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями, например, с кислородом, образуя CuО, Cu2О в зависимости от условий:
4Cu + О2 → 2Cu2О
2Cu + О2 → 2CuО
1.2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
Видеоопыт взаимодействия меди с серой можно посмотреть здесь.
1.3. Медь взаимодействует с галогенами. При этом образуются галогениды меди (II):
Cu + Cl2 = CuCl2
Сu + Br2 = CuBr2
Но, обратите внимание:
2Cu + I2 = 2CuI
Видеоопыт взаимодействия меди с хлором можно посмотреть здесь.
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
Cu + H2 ≠
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2Cu + H2O + CO2 + O2 = (CuOH)2CO3
2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например, медь не реагирует с разбавленной серной кислотой:
Cu + H2SO4 (разб.) ≠
Видеоопыт взаимодействия меди с соляной кислотой можно посмотреть здесь.
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой. При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
Cu + 2H2SO4(конц.) → CuSO4 + SO2 + 2H2O
2.4. Медь реагирует даже при обычных условиях с азотной кислотой.
С концентрированной азотной кислотой:
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
С разбавленной азотной кислотой:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
Реакция меди с азотной кислотой
2.5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей.
Например, медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
2FeCl3 + Cu = 2FeCl2 + CuCl2
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами:
1. Термическим разложением гидроксида меди (II) при 200°С:
Cu(OH)2 → CuO + H2O
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
(CuOH)2CO3 2CuO + CO2 + H2O
2Cu(NO3)2 2CuO + 4NO2 + O2
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства). При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например, оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
Видеоопыт взаимодействия оксида меди (II) с серной кислотой можно посмотреть здесь.
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например, оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
CuO + SO3 → CuSO4
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например, оксид меди (II) окисляет аммиак:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Видеоопыт взаимодействия оксида меди (II) с водородом можно посмотреть здесь.
Более активные металлы вытесняют медь из оксида.
Например, алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
CH3CHO + 2Cu(OH)2 → CH3COOH + Cu2O↓ + 2H2O
CH2ОН(CHOН)4СНО + 2Cu(OH)2 → CH2ОН(CHOН)4СООН + Cu2O↓ + 2H2O
Химические свойства оксида меди (I)
1. Оксид меди (I) обладает основными свойствами.
При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду:
Например, соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl↓ + H2O
2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
Cu2O + 3H2SO4(конц.) = 2CuSO4 + SO2 + 3H2O
Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
5Cu2O + 13H2SO4 + 2KMnO4 = 10CuSO4 + 2MnSO4 + K2SO4 + 13H2O
3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2]+. Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH
CuCl + 2NH3 = [Cu(NH3)2]Cl
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом:
СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl + 2NH3
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например, при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя:
Cu2O + CO = 2Cu + CO2
Cu2O + H2 = 2Cu + H2O
3Cu2O + 2Al = 6Cu + Al2O3
А под действием окислителей, например, кислорода — свойства восстановителя:
2Cu2O + O2 = 4CuO
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например, хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных).
1. Взаимодействует с кислотами.
Например, взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
Сu(OН)2 + 2HBr = CuBr2 + 2H2O
Cu(OН)2 + 2HCl = CuCl2 + 2H2O
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4]
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается:
Сu(OH)2 → CuO + H2O
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность. Как восстановители они реагируют с окислителями.
Например, хлорид меди (I) окисляется концентрированной азотной кислотой:
CuCl + 3HNO3(конц.) = Cu(NO3)2 + HCl + NO2 + H2O
Также хлорид меди (I) реагирует с хлором:
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
2CuI + 4H2SO4 + 2MnO2 = 2CuSO4 + 2MnSO4 + I2 + 4H2O
Иодид меди (I) реагирует с концентрированной серной кислотой:
4CuI + 5H2SO4(конц.гор.) = 4CuSO4 + 2I2 + H2S + 4H2O
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Cu2S + 8HNO3(конц.хол.) = 2Cu(NO3)2 + S + 4NO2 + 4H2O
Cu2S + 12HNO3(конц.гор.) = Cu(NO3)2 + CuSO4 + 10NO2 + 6H2O
Для соединений меди (I) возможна реакция диспропорционирования:
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2]+ получают растворением в концентрированном растворе аммиака:
CuCl + 3NH3 + H2O → [Cu(NH3)2]OH + NH4Cl
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например, соли меди (II) окисляют иодиды и сульфиты:
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
2CuCl2 + Na2SO3 + 2NaOH = 2CuCl + Na2SO4 + 2NaCl + H2O
Бромиды и иодиды меди (II) можно окислить перманганатом калия:
5CuBr2 + 2KMnO4 + 8H2SO4 = 5CuSO4 + K2SO4 + 2MnSO4 + 5Br2 + 8H2O
Соли меди (II) также окисляют сульфиты:
2CuSO4 + Na2SO3 + 2H2O = Cu2O + Na2SO4 + 2H2SO4
Более активные металлы вытесняют медь из солей.
Например, сульфат меди (II) реагирует с железом:
CuSO4 + Fe = FeSO4 + Cu
Cu(NO3)2 + Fe = Fe(NO3)2 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой. При нагревании возможно образование сульфата меди (II):
CuS + 8HNO3(конц.гор.) = CuSO4 + 8NO2 + 4H2O
Еще одна форма этой реакции:
CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например, растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Электролиз раствора нитрата меди (II):
2Cu(NO3)2 + 2Н2О → 2Cu + O2 + 4HNO3
Некоторые соли меди при нагревании разлагаются, например, нитрат меди (II):
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
(CuOH)2CO3 → 2CuO + CO2 + H2O
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2
Медь и соединения меди
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.

9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
Ответы и решения
1.
CuCl2 Cu + Сl2
на катоде на аноде
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 =2CuO + 4NO2↑ + O2↑
6NaOH(гор.) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
2.
CuCl2 = Cu + Сl2
на катоде на аноде
Cu + S = CuS
CuS + 8HNO3(конц.гор.) = CuSO4 + 8NO2↑ + 4H2O
или CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
3.
NaNO3(тв.) + H2SO4(конц.) = HNO3 + NaHSO4
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
2NaNO3 = 2NaNO2 + O2↑
4.
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CuO + 2HNO3 = Cu(NO3)2 + H2O
5. 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Cu(NO3)2 + 2КOH = Cu(OH)2↓ + 2КNO3
Cu(OH)2 = CuO + H2O
CuO + C Cu + CO
6. Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 5H2SO4 = CuSO4 + 4NH4HSO4 + 2H2O
7. Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
8. (CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + H2 = Cu + H2O
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
CuSO4 + Cu + 2NaCl = 2CuCl↓ + Na2SO4
9.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
на катоде на аноде
2Na + O2 = Na2O2
2Na2O2 + CO2 = 2Na2CO3 + O2
10.
(CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
3CuO + 2NH3 = 3Cu + N2 + 3H2O
11.
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 = CuO + H2O
CuO + H2 = Cu + H2O
12.
Cu + Cl2 = CuCl2
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Cu(OH)2 = CuO + H2O
CuO + C = Cu + CO
13.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
CuO + H2 = Cu + H2O
14.
2Cu + O2 = 2CuO
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + NaOH = Cu(OH)2↓ + Na2SO4
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
15.
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 = CuO + H2O
CuO + C = Cu + CO
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
16.
2Cu + I2 = 2CuI
2CuI + 4H2SO4 = 2CuSO4 + I2 + 2SO2 + 4H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 = CuO + H2O
17.
2CuCl2 + 2Na2CO3 + H2O = (CuOH)2CO3 + CO2 + 4NaCl
(CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + H2 = Cu + H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
18.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 3H2SO4 = CuSO4 + 2(NH4)2SO4 + 2H2O
19) Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4NH4Cl + 2H2O
20.
Fe + 2HCl = FeCl2 + H2
CuO + H2 = Cu + H2O
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
21.
I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4NO2 + 2H2O + O2 = 4HNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
22.
Cu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 = CuO + H2O
3CuO + 2NH3 = 3Cu + N2 + 3H2O
23.
CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
24.
CuO + CO = Cu + CO2
Cu + Cl2 = CuCl2
2CuCl2 + 2KI = 2CuCl↓ + I2 + 2KCl
CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
.
25.
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
26.
H2C2O4 = CO↑ + CO2↑ + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
2Cu(NO3)2 =2CuO + 4NO2↑ + O2↑
CuO + CO = Cu + CO2
27.
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
SO2 + 2KOH = K2SO3 + H2O
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
|
Медь / Cuprum (Cu) |
|
|---|---|
| Атомный номер |
29 |
| Внешний вид простого вещества |
пластичный металл золотисто-розового цвета
Файл:Cu,29.jpg |
| Свойства атома | |
| Атомная масса (молярная масса) |
63,546 а. е. м. (г/моль) |
| Радиус атома |
128 пм |
| Энергия ионизации (первый электрон) |
745,0 (7,72) кДж/моль (эВ) |
| Электронная конфигурация |
[Ar] 3d10 4s1 |
| Химические свойства | |
| Ковалентный радиус |
117 пм |
| Радиус иона |
(+2e) 72 (+1e) 96 пм |
| Электроотрицательность (по Полингу) |
1,90 |
| Электродный потенциал |
+0,337 В/ +0,521 В |
| Степени окисления |
2, 1 |
| Термодинамические свойства простого вещества | |
| Плотность |
8,96 г/см³ |
| Удельная теплоёмкость |
24,465 Дж/(K·моль) |
| Теплопроводность |
401 Вт/(м·K) |
| Температура плавления |
1356,6 K |
| Теплота плавления |
13,01 кДж/моль |
| Температура кипения |
2840 K |
| Теплота испарения |
304,6 кДж/моль |
| Молярный объём |
7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая гранецентрированая |
| Период решётки |
3,615 Å |
| Отношение c/a |
n/a |
| Температура Дебая |
315,00 K |
Медь — химический элемент с атомным номером 29 в периодической системе, обозначается символом Cu (лат. Cuprum от названия острова Кипр где добывали медь), красновато-золотистого цвета (розовый при отсутствии оксидной пленки). Простое вещество медь — это пластичный переходный металл, с давних пор широко применяемый человеком.
История и происхождение названия
Файл:Electron shell 029 Copper.svg Схема атома меди
Из-за сравнительной доступности для получения из руды и малой температуры плавления медь — один из первых металлов, широко освоенных человеком. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Нахождение в природе
Файл:CopperMineralUSGOV.jpg Самородная медь
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2.
Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, Меденосный пояс Центральной Африки и Мансфельд в ГДР.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,4 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два различных варианта распада с различными продуктами.
Плотность — 8,94*10³ кг/м³
Удельная теплоёмкость при 20 °С — 390 Дж/кг*К
Удельное электрическое сопротивление при 20-100 °С — 1,78·10-8 Ом·м
Существует ряд сплавов меди: латунь — сплав меди с цинком, бронза — сплав меди с оловом, мельхиор — сплав меди и никеля, и некоторые другие.
Химические свойства
Хорошо проводит тепло. На воздухе покрывается оксидной плёнкой.
Соединения
Файл:Copper sulfate.jpg Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23-, полученных в 1994 году.
Карбонат меди(II) имеет зелёную окраску, что вызывает позеленение элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди(I)
Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников.
Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов.
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [3], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004.
Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Наиболее распространённые сплавы — бронза и латунь
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широкораспространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, куда помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников.
Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Другие сферы применения
Медь самый широкоупотребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди применять для транспортировки ацетилена можно только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в кровельном деле. Кровли из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 [4]
Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учереждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Биологическая роль
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта [5].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[1]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей.[источник?]
Бактерицидность
Бактерицидные свойства меди и ее сплавов были известны человеку давно.
В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) [6] официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью [7]. Особено выраженно бактерицидное действие поверхностей медных (и сплавов меди) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, извесного как «супермикроб» MRSA [8]:
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т. [2] [3]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы [2], на долю России приходилось 3.2 % общих и 3.1 % подтверждённых мировых запасов [2]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 1,009 тыс. тонн, потребление — 714 тыс. тонн[4]. Основными производителями меди в России являются:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
Как добывают медь
Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Нашли однажды самородок, который весил 420 т. Наверняка медь была первым металлом, с которым познакомились древние люди. Первые свои орудия делали они из кремниевой и железной руды, из меди, и уже потом научились изготовлять их из бронзы и железа. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н.э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало ее пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. Добычу меди называют прабабушкой металлургии. Ее добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н.э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н.э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно мед-ные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
Большая часть добываемой меди используется в электротехнике, потому что медь обладает высокой электропроводностью, уступая в этом только серебру, которое, конечно, намного дороже. Миллионы километров проводов опутали земной шар, и большинство из них медные. Медь нужна для производства двигателей, телевизоров, телефонных аппаратов, различных электроприборов, автомобилей, электровозов, холодильников и даже музыкальных инструментов. Ее используют в химической промышленности для борьбы с вредителями садов и огородов, для подкормки растений и животных. Всюду нужна медь.
По объему мирового производства и потребления медь занимает третье место после железа и алюминия.
Стандарты для медных сплавов
На территории нашей страны существует большое количество регламентов, используемых в качестве основных стандартов, обязательных для исполнения при работе с медью. К основным регламентам относятся:
- ГОСТ 859-2014 «Медь. Марки».
- ГОСТ 193-2015 «Слитки медные. Технические условия».
Для отдельных типов сплавов (бронзы, латуни) существуют свои регламенты. Стандарты периодически обновляются.
Ранее данный регламент являлся основным для меди и медных сплавов. Однако в 2014 году он был заменен на ГОСТ 859-2014. В нем прописаны основные марки с учетом современных нововведений и дополненных требований к процессам производства, способам получения и так далее.[5]
Ссылки
| Медь на Викискладе? |
- Теплопроводность и теплофизические свойства меди
- Медь на Webelements
- Медь в Популярной библиотеке химических элементов
- Медь в месторождениях
- Российский Центр Меди
- Некоммерческий ресурс о меди (eng)
Примечания
- ↑ [1]
- ↑ 2,0 2,1 2,2 http://www.ecsocman.edu.ru/db/msg/142462.html
- ↑ http://www.metalinfo.ru/ru/news/12150
- ↑ Минпромэнерго РФ, «Стратегия развития металлургической промышленности Российской Федерации на период до 2015 года» [2]
- ↑ Классификация меди по ГОСТу.
Эта страница использует содержимое раздела Википедии на русском языке. Оригинальная статья находится по адресу: Медь. Список первоначальных авторов статьи можно посмотреть в истории правок. Эта статья так же, как и статья, размещённая в Википедии, доступна на условиях CC-BY-SA .
Медь
Медь — элемент побочной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко применяется человеком.
История и происхождение названия
Медь — один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди.
У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр, ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник. Сторонники индогерманской теории происхождения европейских языков производят русское слово медь (польск. miedz, чешск. med) от древненемецкого smida (металл) и Schmied (кузнец, англ. Smith). Конечно, родство корней в данном случае несомненно, однако, оба эти слова произведены от греч. рудник, копь независимо друг от друга. От этого слова произошли и родственные названия — медаль, медальон (франц. medaille). Слова медь и медный встречаются в древнейших русских литературных памятниках. Алхимики именовали медь венера (Venus). В более древние времена встречается название марс (Mars).
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра).
Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем, баббиты — со свинцом и другие.
Химические свойства
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не реагирует с водой, разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами.
Современные способы добычи
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её выщелачивания слабым раствором серной кислоты и последующего выделения металлической меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20-40 % железа, 22-25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки 1450 °C.
С целью окисления сульфидов и железа, полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4 — 99,4 % меди, 0,01 — 0,04 % железа, 0,02 — 0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0 — 99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5-12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
Источник: Википедия
Другие заметки по химии
| Медь | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Никель | Цинк → | |||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
| Внешний вид простого вещества | |||||||||||||||||||||||||||

Самородная медь |
|||||||||||||||||||||||||||
| Свойства атома | |||||||||||||||||||||||||||
| Название, символ, номер | Медь/Cuprum (Cu), 29 | ||||||||||||||||||||||||||
| Группа, период, блок |
11 (устар. 1), 4, d-элемент |
||||||||||||||||||||||||||
| Атомная масса (молярная масса) |
63,546(3)[1] а. е. м. (г/моль) | ||||||||||||||||||||||||||
| Электронная конфигурация |
[Ar] 3d104s1 1s22s22p63s23p63d104s1 |
||||||||||||||||||||||||||
| Радиус атома | 128 пм | ||||||||||||||||||||||||||
| Химические свойства | |||||||||||||||||||||||||||
| Ковалентный радиус | 117 пм | ||||||||||||||||||||||||||
| Радиус иона | (+2e) 73 (+1e) 77 (K=6) пм | ||||||||||||||||||||||||||
| Электроотрицательность | 1,90 (шкала Полинга) | ||||||||||||||||||||||||||
| Электродный потенциал | +0,337 В/ +0,521 В | ||||||||||||||||||||||||||
| Степени окисления | 0; +1; +2; +3; +4 | ||||||||||||||||||||||||||
| Энергия ионизации (первый электрон) |
745,0 (7,72) кДж/моль (эВ) | ||||||||||||||||||||||||||
| Термодинамические свойства простого вещества | |||||||||||||||||||||||||||
| Плотность (при н. у.) | 8,92 г/см³ | ||||||||||||||||||||||||||
| Температура плавления | 1356,55 K (1083,4 °С) | ||||||||||||||||||||||||||
| Температура кипения | 2567 °С | ||||||||||||||||||||||||||
| Уд. теплота плавления | 13,01 кДж/моль | ||||||||||||||||||||||||||
| Уд. теплота испарения | 304,6 кДж/моль | ||||||||||||||||||||||||||
| Молярная теплоёмкость | 24,44[2] Дж/(K·моль) | ||||||||||||||||||||||||||
| Молярный объём | 7,1 см³/моль | ||||||||||||||||||||||||||
| Кристаллическая решётка простого вещества | |||||||||||||||||||||||||||
| Структура решётки | Кубическая гранецентрированая | ||||||||||||||||||||||||||
| Параметры решётки | 3,615 Å | ||||||||||||||||||||||||||
| Температура Дебая | 315 K | ||||||||||||||||||||||||||
| Прочие характеристики | |||||||||||||||||||||||||||
| Теплопроводность | (300 K) 401 Вт/(м·К) | ||||||||||||||||||||||||||
| Номер CAS | 7440-50-8 | ||||||||||||||||||||||||||
| Наиболее долгоживущие изотопы | |||||||||||||||||||||||||||
|
Основная статья: Изотопы меди
|
Медь (химический символ — Cu, от лат. Cuprum) — химический элемент 11-й группы (по устаревшей классификации — побочной подгруппы первой группы, IB) четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29.
В виде простого вещества медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки).
C давних пор широко используется человеком.
История
Медь — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк[3]. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий[4].
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопках. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 см по сторонам и 0,5 мм толщиной. Монета имела хождение по всему западному побережью Южной Америки, в том числе и в государстве Инков[5].
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике[6].
Происхождение названия
Латинское название меди Cuprum (древнелат. aes cuprium, aes cyprium) произошло от названия острова Кипр, где было богатое месторождение.
У Страбона медь именуется χαλκός, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди aes (санскр. ayas, готск. aiz, нем. erz, англ. ore) означает руда или рудник.
Слова медь и медный встречаются в древнейших русских литературных памятниках: ст.‑слав. *mědь «медь» не имеет чёткой этимологии, возможно, исконное слово[7][8]. В. И. Абаев предполагал происхождение слова от названия страны Мидия: *Мѣдь из ир. Мādа — через посредство греч. Μηδία[9]. Согласно этимологии М. Фасмера, слово «медь» родственно др-герм. smid «кузнец», smîdа «металл»[9].
Медь обозначалась алхимическим символом «♀» — «зеркало Венеры», и иногда сама медь именовалась алхимиками тоже как «венера». Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра[10], и из меди делались зеркала. Этот символ Венеры также был изображён на брэнде Полевского медеплавильного завода, им с 1735 по 1759 годы клеймилась полевская медь, и изображён на современном гербе города Полевской[10][11]. С Гумёшевским рудником Полевского, — крупнейшим в XVIII−XIX веках месторождением медных руд Российской империи на Среднем Урале, — связан известный персонаж сказов П. П. Бажова — Хозяйка медной горы, покровительница добычи малахита и меди. По одной из гипотез, она является преломлённым народным сознанием образом богини Венеры[10].
Нахождение в природе

Самородная медь
Среднее содержание меди в земной коре (кларк) — (0,78-1,5)·10−4[12]% (по массе)[2]. В морской и речной воде содержание меди гораздо меньше: 3·10−7 % и 10−7 % (по массе) соответственно[2].
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн[13].
Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[14].
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Физические свойства

Кристаллы меди
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло-[15] и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5—58 МСм/м[16]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры.
Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Атомная плотность меди (N0) = 
Изотопы меди
Природная медь состоит из двух стабильных изотопов — 63Cu (изотопная распространённость 69,1 %) и 65Cu (30,9 %). Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа[17].
Получение
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод
- Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырьё содержит 0,5—2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400 °C :
Затем обожжённый концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
Образующийся силикат в виде шлака всплывает, и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезёма выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической (черновой) меди:
Получаемая металлическая (черновая) медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкислённого раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
- Также чистую медь можно получить и в процессе экзотермической реакции восстановления оксида меди водородом:
Гидрометаллургический метод
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
Электролизный метод
Электролиз раствора сульфата меди:
Химические свойства
Возможные степени окисления

В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях и комплексах можно получить соединения со степенью окисления +3, +4 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Простое вещество
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
Реагирует с концентрированной холодной серной кислотой:
С концентрированной горячей серной кислотой:
С безводной горячей серной кислотой:
C разбавленной серной кислотой при нагревании в присутствии кислорода в воздухе:
С концентрированной азотной кислотой:
С разбавленной азотной кислотой:
С «царской водкой»:
С концентрированной горячей соляной кислотой:
C разбавленной соляной кислотой в присутствии кислорода:
C разбавленной соляной кислотой в присутствии перекиси водорода:
С газообразным хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
Окисляется до оксида меди(I) при недостатке кислорода при температуре 200 °C и до оксида меди(II) при избытке кислорода при температурах порядка 400—500 °C:
Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре:
С йодом (йодида меди(II) не существует):
При 300—400 °C реагирует с серой и селеном:
C оксидами неметаллов:
С концентрированной соляной кислотой и хлоратом калия:
С хлоридом железа(III):
Вытесняет менее активные металлы из их солей:
Соединения меди(I)
Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы.
Также присутствую не растворимые в воде комплексы(например, дихлорокупрат(I)-ион [CuCl2]− устойчив:
-
)
Следует обратить внимание на то, что сульфат меди(I) нестабилен Он мгновенно разлагается и переходит в устойчивый сульфат меди(II).
- Большинство соединений имеют белую окраску либо бесцветны.
Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют:
Примером диспропорционирования может служить реакция оксида меди(I) с разбавленной серной кислотой:
Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета, который
разлагается при температуре 1800°С:
Можно восстановить до элементарной меди:
Также протекает процесс алюминотермии:
Реагирует с концентрированными растворами щелочей:
С концентрированной соляной кислотой:
С разбавленными галоген кислотами(Hal = Cl, Br, I):
С разбавленной соляной кислотой в присутствии кислорода:
С концентрированной азотной кислотой:
С концентрированной серной кислотой:
С разбавленной серной кислотой:
С гидросульфитом натрия:
С аммиаком:
С раствором аммиака:
С азотистоводородной кислотой в разных условиях при охлаждении:
С серой:
С Сульфидом меди(I):
С кислородом:
С хлором:
С оксидами щелочных металлов(Ме = Li, Na, K, Rb, Cs):
С оксидом бария:
Соответствующий гидроксид CuOH (жёлтого цвета) разлагается при темперауре 100°С с образованием оксида меди(I).
Гидроксид CuOH проявляет основные свойства.
Также реагирует с раствором аммиака:
Реагирует с гидроксидом калия:
Соединения меди(II)
Степень окисления II — наиболее стабильная степень окисления меди. Ей соответствует оксид CuO чёрного цвета, который разлагается при температуре 1100 °С:
Реагирует с раствором аммиака с образованием Реактива Швейцера:
Растворяется в концентрированных щелочах с образованием комплексов:
При сплавлении с щелочами образуются купраты металлов:
С азотной кислотой:
Реагирует с йодоводородной кислотой с образованием йодида меди(I), так как йодида меди(II) не существует:
Протекают процессы магниетермии и алюминотермии:
Также можно восстановить до элементарной меди следующими способами:
Оксид меди(II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников.
Соответствующий гидроксид Cu(OH)2 (голубого цвета), который при длительном стоянии разлагается, переходя в оксид меди(II) чёрного цвета:
Также в избытке влаги возможно окисление меди, и переход в гидроксид куприла, в котором степень окисления меди +3:
При нагревании до 70 °С разлагается:
Реагирует с растворами концентрированных щелочей с образованием гидроксокомплексов синего цвета (это подтверждает преимущественно основный характер Cu(OH)_2):
С образованием солей меди(II) растворяется во всех кислотах(в том числе кислотах окислителях) кроме йодоводородной:
Реакция с йодоводородной кислотой отличается тем, что образуется йодид меди(I), так как йодида меди(II) не существует:
Реакция с водным раствором аммиака является из важных в химии, так как образуется реактив Швейцера (растворитель целлюлозы):
Также суспензия гидроксида меди реагирует с углекислым газом с образованием дигидроксокарбонатом меди(II):
Большинство солей двухвалентной меди имеют синюю или зелёную окраску.
При растворении солей меди(II) в воде образуются голубые аквакомплексы [Cu(H2O)6]2+.
Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга).
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды

Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид.
Соединения меди(III) и меди(IV)
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Оксид меди(III) не получен. Под этим названием описаны различные купраты(III).
Гексафторкупраты(III) и (IV) получают действием фтора на соли меди и щелочных металлов при нагревании под давлением. Они бурно реагируют с водой и являются сильными окислителями.
Комплексы меди(III) с ортопериодатами и теллуратами относительно стабильны и предложены как окислители в аналитической химии. Описано много комплексов меди(III) с аминокислотами и пептидами.
Аналитическая химия меди

Возбуждённые атомы меди окрашивают пламя в голубовато-зелёный цвет
Медь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки, при внесении в него платиновой проволочки, смоченной исследуемым раствором.
- Традиционно количественное определение меди в слабокислых растворах проводилось с помощью пропускания через него сероводорода, при этом сульфид меди выпадает в далее взвешиваемый осадок.
- В растворах, при отсутствии мешающих ионов, медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими и спектральными методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C: 0,01724—0,0180 мкОм·м/[16]), медь широко применяется в электротехнике для изготовления силовых и других кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %[18].

Самое частое применение меди — электротехника
Теплообмен

Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Для производства труб
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005[19], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Сплавы
Сплавы на основе меди

Латунная игральная кость, рядом цинк и слиток меди

Статуэтка, отлитая из бронзы
В разнообразных областях техники широко используются сплавы с использованием меди,
самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь.
Оба сплава являются общими названиями для целого семейства материалов,
в которые, помимо олова и цинка, могут входить никель, висмут и другие металлы.
Например, в состав пушечной бронзы, использовавшейся для изготовления артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия.
Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности.
Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди.
Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Медь и её сплавы с латунью и бронзой обладают высокой коррзионой стойкостью, электро- и теплопроводностью, антифрикционными показателями. При этом медь хорошо сваривается и обрабатывается резанием. [20]
Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[21].
Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости.
Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 °C , обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.
Сплавы, в которых медь значима

Повреждённая пожаром дюралевая деталь дирижабля Гинденбург (LZ 129)
Дюраль (дюралюминий) определяют как сплав алюминия и меди (меди в дюрали 4,4 %).
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия-бария-меди (купрата) YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников.
Медь применяется для производства медно-окисных гальванических элементов и батарей.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за того, что медь является катализатором полимеризации ацетилена (образует соединения меди с ацетиленом), трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006[22].
Медь может быть использована для снижения переноса инфекции в лечебных учреждениях через поверхности, к которым прикасается рука человека. Из меди могут быть изготовлены ручки дверей, водозапорной арматуры, перила, поручни кроватей, столешницы.[23]
Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 510 и 578 нм[24].
Также медь применяется в пиротехнике для окрашивания в синий цвет.[источник не указан 788 дней]
Стоимость
В январе 2008 года, впервые за всю историю, на Лондонской бирже металлов цены на медь превысили 8000 долларов США за тонну. В начале июля цены возросли до 8940 долларов за тонну, что стало абсолютным рекордом начиная с 1979 года — момента начала ведения торгов на ЛБМ. Цена достигла пика в почти 10,2 тыс. долларов в феврале 2011 года[25].
На 2011 год стоимость меди составляла около 8900 долларов за тонну[26]. Вследствие кризиса мировой экономики цена на большинство видов сырья упала, и стоимость 1 тонны меди на 1 сентября 2016 не превышала 4700 долларов[27]. В мае 2021 цена меди взлетела до 10307$ за тонну на бирже.[28]
Биологическая роль

Продукты, богатые медью.
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей[29].
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 1 мг/л (СанПиН 2.1.4.1074-01), однако недостаток меди в питьевой воде также нежелателен. Всемирная организация здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта[30].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[30]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Бактерицидность
Бактерицидные свойства меди и её сплавов были известны человеку давно.
В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[31] (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выраженно бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA[32]. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/H1N1 (т. н. «свиной грипп»)[33].
Органолептические свойства
Излишняя концентрация ионов меди придаёт воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн т[34][35]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы[34], на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов[34]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. т, потребление — 591,4 тыс. т[36].
Основными производителями меди в России являлись:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское»[37].
Мировое производство меди в 2007 году составляло[38] 15,4 млн т, а в 2008 году — 15,7 млн т. Лидерами производства были:
Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.),
США (1,170/1,310),
Перу (1,190/1,220),
Китай (0,946/1,000),
Австралия (0,870/0,850),
Россия (0,740/0,750),
Индонезия (0,797/0,650),
Канада (0,589/0,590),
Замбия (0,520/0,560),
Казахстан (0,407/0,460),
Польша (0,452/0,430),
Мексика (0,347/0,270).
По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
Выплавка меди в 2019 ожидается 25,5 млн т[39]
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается, что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Современные способы добычи
Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская Республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду (расположен в Чили). В зависимости от глубины залегания, руда добывается открытым или закрытым методом.[40]
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её растворения в слабом растворе серной кислоты и последующего выделения металлической (черновой) меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки — 1450 °C.
С целью окисления сульфидов и железа полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит раствор серной кислоты с медным купоросом. В ходе электролиза происходит повышение концентрации серной кислоты. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлама, который идёт на переработку с целью извлечения ценных металлов. При получении 1000 тонн электролитической меди можно получить до 3 кг серебра и 200 г золота. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах[41].
Влияние на экологию
При открытом способе добычи после её прекращения карьер становится источником токсичных веществ. Самое токсичное озеро в мире — Беркли Пит — образовалось в карьере медного рудника.
См. также
- Бронза
- Купраты
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ 1 2 3 Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1992. — Т. 3. — С. 7. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.
- ↑ Спиридонов, 1989, с. 5—8.
- ↑ Спиридонов, 1989, с. 20—22.
- ↑ Waldemar Espinoza Soriano. Etnohistoria ecuatoriana: estudios y documentos (исп.). — Quito: Abya-Yala, 1988. — С. 135.
- ↑ Спиридонов, 1989, с. 172.
- ↑ Этимологический словарь славянских языков, том 18. — М.: Наука, 1993. — С. 144−146.
- ↑ Откупщиков Ю. В. Очерки по этимологии. — СПб.: Издательство Санкт-Петербургского университета. — 2001. — С. 127−130.
- ↑ 1 2 медь // Этимологический словарь русского языка = Russisches etymologisches Wörterbuch : в 4 т. / авт.-сост. М. Фасмер ; пер. с нем. и доп. чл.‑кор. АН СССР О. Н. Трубачёва, под ред. и с предисл. проф. Б. А. Ларина [т. I]. — Изд. 2-е, стер. — М. : Прогресс, 1986—1987.
- ↑ 1 2 3 Перфильев А. В. Герб и символы Полевского // Полевской край: Историко-краеведческий сборник. — Екатеринбург : Уралтрейд, 1998. — Вып. 1, № 3. — (Уральское краеведение).
- ↑ Официальные символы Архивная копия от 15 октября 2016 на Wayback Machine, на сайте Администрации Полевского городского округа
- ↑ Григорьев Н.А. Распределение химических элементов в верхней части континентальной коры / отв. ред. д.г.-м.н. Сазонов В.Н.. — Екатеринбург: УрО РАН, 2009. — С. 36. — 383 с. — ISBN isbn 978-5-7691-2038-1.
- ↑ Медь самородная — статья из Большой советской энциклопедии.
- ↑ Крупнейшие мономинеральные месторождения (рудные районы, бассейны). Дата обращения: 29 ноября 2010. Архивировано из оригинала 19 июня 2010 года.
- ↑ при 20 °С: 394,279 Вт/(м·К), то есть 0,941 кал/(см·сек·°С)
- ↑ 1 2 Электротехнический справочник. Т. 1. / Составитель И. И. Алиев. — М. : ИП РадиоСофт, 2006. — C. 246. — ISBN 5-93037-157-1
- ↑ Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- ↑ Применение меди Архивная копия от 14 сентября 2010 на Wayback Machine (недоступная ссылка с 21-05-2013 [3521 день] — история, копия)
- ↑ ГОСТ Р 52318-2005 Трубы медные круглого сечения для воды и газа. Технические условия. Дата обращения: 24 июля 2008. Архивировано 14 сентября 2008 года.
- ↑ Грудев А. П., Машкин Л. Ф., Ханин М. И. Технология прокатного производства. — М.: Металлургия, 1994. — С. 441. — 656 с. — ISBN 5-229-00838-5.
- ↑ Смирягин А. П., Смирягина Н. А., Белова А. В. Промышленные цветные металлы и сплавы. — 3-е изд. — Металлургия, 1974. — С. 321—488.
- ↑ СП 31-116-2006 Проектирование и устройство кровель из листовой меди. Дата обращения: 25 декабря 2009. Архивировано 8 ноября 2009 года.
- ↑ Hannah Bloch. A Copper Bedrail Could Cut Back On Infections For Hospital Patients. Дата обращения: 11 ноября 2020. Архивировано 8 ноября 2020 года.
- ↑ Исаев А. А. Лазер на парах меди. Дата обращения: 6 января 2015. Архивировано 4 марта 2016 года.
- ↑ Цены на сырьё упали до самого низкого уровня со времен кризиса 2008 г. / Новости / Finance.UA. Дата обращения: 26 апреля 2015. Архивировано 6 октября 2014 года.
- ↑ Цена меди. Дата обращения: 28 мая 2011. Архивировано 1 апреля 2013 года.
- ↑ Графики цены меди за различные периоды. Дата обращения: 1 сентября 2016. Архивировано 29 августа 2016 года.
- ↑ Цена на медь достигла рекордно высокого значения в ходе торгов — Экономика и бизнес — ТАСС. Дата обращения: 13 сентября 2021. Архивировано 13 сентября 2021 года.
- ↑ Медь и рост человека // Наука и жизнь. — М.: «Правда», 1990. — № 1. — С. 17.
- ↑ 1 2 CHEMICAL FACT SHEETS (англ.). Дата обращения: 29 декабря 2009. Архивировано 22 августа 2011 года.
- ↑ US EPA. Дата обращения: 25 июля 2008. Архивировано 29 сентября 2015 года.
- ↑ В США наблюдается вспышка инфекции MRSA за пределами госпиталей. Дата обращения: 25 июля 2008. Архивировано 12 октября 2008 года.
- ↑ British Scientist Shares Expertise on Swine Flu Control in Beijing. Дата обращения: 11 января 2010. Архивировано из оригинала 23 сентября 2012 года.
- ↑ 1 2 3 Производство меди. Дата обращения: 17 ноября 2007. Архивировано 5 октября 2008 года.
- ↑ В 2005 г. мировая добыча меди увеличится на 8 % до 15,7 млн т. — Новости металлургии
- ↑ Стратегия развития металлургической промышленности Российской Федерации на период до 2020 года. Минпромэнерго РФ (18 марта 2009). Дата обращения: 29 декабря 2009. Архивировано из оригинала 18 октября 2010 года.
- ↑ Металлонвест оплатил лицензию за Удокан
- ↑ MINERAL COMMODITY SUMMARIES 2009. Дата обращения: 30 сентября 2009. Архивировано 6 августа 2011 года.
- ↑ Мировой рынок столкнется с дефицитом меди в 2019 году — Ведомости. Дата обращения: 10 марта 2020. Архивировано 24 июня 2020 года.
- ↑ Способы и места добычи меди. promzn.ru. Дата обращения: 25 августа 2018. Архивировано 26 августа 2018 года.
- ↑ Получение меди. Дата обращения: 29 января 2011. Архивировано 11 февраля 2011 года.
Литература
- Данные на начало XX века:. Медь // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Спиридонов А. А. В служеньи ремеслу и музам. — 2-е изд. — М.: Металлургия, 1989. — 176 с. — (Научно-популярная библиотека школьника). — 50 000 экз. — ISBN 5-229-00355-3.
- Фримантл М. Химия в действии. — М.: «Мир», 1991. — Т. 2.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. — «Химия», 2000. — С. 286.
- Максимов М. М., Горнунг М. Б. Очерк о первой меди. — М.: Недра, 1976. — 96 с. — 40 000 экз.
Ссылки
- Медь на Webelements
- Медь в Популярной библиотеке химических элементов
- Российский Центр Меди, некоммерческий
- Медь в месторождениях
- Некоммерческий ресурс о меди (eng)
Эта страница в последний раз была отредактирована 28 октября 2022 в 17:34.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
Медь не относится к благородным или редким элементам. Это самый распространенный цветной металл на Земле. Благодаря своим характеристикам в почете у промышленников и ювелиров. Предмет охоты сборщиков лома.
Содержание
- Что представляет собой
- История
- Запасы, добыча
- Физико-химические параметры
- Медь в природе
- Способы получения
- Пирометаллургический
- Гидрометаллургический
- Сплавы
- Сферы применения
- Промышленность
- Строительство
- Медицина
- Ювелирное дело
- Другие отрасли
- Значение для человека
- Предостережение
- Цены
Что представляет собой
Медь – это розоватый металл с золотисто-металлическим блеском. Элемент №29 периодической системы Менделеева. Международное обозначение – Cu (Cuprum).
Чистый металл мягок, поэтому чаще используется с примесями. Пластичен: вытягивается до микронных диаметров.
На воздухе покрывается пленкой, обретая желтовато-красный оттенок. Тонкие пластинки на просвет зеленовато-голубые.
По официальной классификации причислен к тяжелым цветным металлам. В эту же группу входят свинец, цинк, олово, никель.
История
Медь – один из первых металлов, с которыми имело дело человечество. Этому способствовали преимущества: большая распространенность, доступность, относительно низкая температура плавления.
Достоинства меди люди оценили восемь тысячелетий назад.
Медный век начался сразу после каменного:
- Древнейшими признаны медные артефакты, откопанные на территории современной Турции. Это бусинки и декоративные накладки.
- Из металла делали режущий инструментарий и посуду.
- История открытия медных рудников на Руси начинается на Урале за две тысячи лет до новой эры. Затем были Кавказ, Алтай, Сибирь.
- Промышленная переработка с использованием бронзы началась в XIV веке. Из сплава отливали пушки и колокола.
Из бронзы отлиты Царь-колокол и Царь-пушка.
Предполагается, что металл назван по имени острова Кипр. Здесь еще в III веке до нашей эры обнаружились медные залежи, а население освоило выплавку меди.
Происхождение русскоязычного термина медь «Этимологический словарь русского языка» М.Фасмера увязывает с древненемецким корнем smid – кузнец, металл.
Запасы, добыча
Глобальные объемы медной руды оцениваются в миллиард тонн (разведанные). Наличие половины подтверждено. Ученые полагают, что земная кора таит еще три миллиарда тонн меденосной руды.
Богатыми запасами располагают страны на всех континентах:
- Америка – Чили, Канада, США.
- Азия – Казахстан, Иран.
- Африка – ЮАР, Замбия, Заир.
На Россию приходится 3% мировых запасов. Месторождения сосредоточены на Урале. Основной добытчик – концерн «Норильский никель».
Руду добывают открытым либо закрытым способом, в зависимости от глубины залегания.
Ежегодный мировой объем добычи руды – 15-20 млн. тонн.
Физико-химические параметры
Медь – металл с типичными внешними признаками (блеск, гладкость) и структурой кристаллической решетки. Наделена высокой электро- и теплопроводностью. По этим физическим свойствам вторая после серебра.
| Название, символ, номер | Медь/Cuprum (Cu), 29 |
|---|---|
| Атомная масса (молярная масса) |
63,546(3)а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Радиус атома | 128 пм |
| Химические свойства | |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 73 (+1e) 77 (K=6) пм |
| Электроотрицательность | 1,90 (шкала Полинга) |
| Электродный потенциал | +0,337 В/ +0,521 В |
| Степени окисления | 3, 2, 1, 0 |
| Энергия ионизации (первый электрон) |
745,0 (7,72) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 8,92 г/см³ |
| Температура плавления | 1356,55 K (1083,4 °С) |
| Температура кипения | 2567 °С |
| Уд. теплота плавления | 13,01 кДж/моль |
| Уд. теплота испарения | 304,6 кДж/моль |
| Молярная теплоёмкость | 24,44 Дж/(K·моль) |
| Молярный объём | 7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3,615 Å |
| Температура Дебая | 315 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 401 Вт/(м·К) |
| Номер CAS | 7440-50-8 |
Главное химическое свойство металла, оцененное человеком, – нулевая коррозийность. Медь химически малоактивна, при стандартных условиях не окисляется.
Медь в природе
В природе выявлено два проявления элемента – самородки и компонент соединений с другими элементами.
Чаще это соединения: оксиды, сульфиды, гидрокарбонаты. Самое распространенное сырье – медный колчедан.
Медь придает глубокие синие, голубые, зеленоватые оттенки малахиту, бирюзе, хризоколле, другим минералам ювелирно-декоративного сегмента.
Способы получения
Содержание металла в рудах не превышает 2%. Поэтому перед плавкой их обогащают. Существует два способа получения меди: пиро- и гидрометаллургический.
Пирометаллургический
Многоуровневый процесс, включающий следующие этапы:
- Обогащение. Руды обогащают методом флотации. Взвешенные в воде медные частички «цепляются» к воздушным пузырькам, которые увлекают их на поверхность. На выходе получается порошок-концентрат с 12-36% меди.
- Обжиг. Процедура показана бедным (9-24% меди) медным рудам и концентратам, сильно «загрязненным» серой. При прокаливании с кислородом доля серы падает вдвое.
- Плавка. Кусками руды или порошком-концентратом загружают печи шахтного либо отражательного типа при 1452°С. Получают медный штейн.
- Продувка. В конвертерах на него воздействуют сжатым воздухом. Сульфиды и железо окисляются, образуется почти чистая (98,51 – 99,51%) черновая медь плюс железо, другие ценные компоненты в следовых количествах.
- Рафинирование. Черновой продукт отправляют на рафинирование – пламенем, затем электролитом. Примеси удаляются с газами. После первого этапа металл очищается до 99,51%, после заключительного – до 99,96%.
Способ применяется к 9/10 добытого сырья.
Гидрометаллургический
Состоит в обработке сырья растворенной серной кислотой малой концентрации и выделении металлического медного продукта.
Метод оптимален для руд с минимальным процентом меди. Извлечения других компонентов не предусматривается.
Сплавы
Номенклатура сплавов меди с другими компонентами насчитывает десятки позиций.
Они применяются чаще чистого металла, поскольку уменьшают недостатки, присущие чистому металлу. То есть делают продукт прочнее, устойчивее, дешевле.
Медные соединения подразделяются на две группы:
- Бронза – с оловом.
- Латунь – с цинком.
Помимо этих главных легирующих компонентов, в составе соединения алюминий, никель, висмут, титан, серебро, золото, неметаллические элементы.
Сферы применения
Свойства металла обусловили его применение разными сферами. Главный потребитель – промышленный комплекс.
Промышленность
Металл и сплавы разбирают следующие отрасли:
- Электротехника, радиоэлектроника. Кабели (силовые, другие), провода. Обмотка в трансформаторах. Теплообменные устройства (радиаторы отопления, кондиционеры, кулеры компьютеров, тепловые трубки ноутбуков).
- Приборо-, машиностроение. Из сплавов меди с цинком, оловом, алюминием делают детали, узлы машин. Без нее невозможно создание гальванических элементов и батарей.
- Трубы. Для транспортировки пара, воды, газа. В энергетике, судостроении, для бытовых потребностей.
В Японии медные трубопроводы признаны сейсмоустойчивыми, что для этой страны жизненно важно.
Строительство
Крыши из медного листа экологичны, их можно не красить, поскольку влага, погодные катаклизмы не страшны. Срок службы – до 100 лет.
Медицина
Медициной востребованы характеристики металла как антисептика и вяжущего средства.
Это компонент глазных капель и смесей для лечения ожогов.
Медные ручки дверей, другие поверхности – атрибут лечебных учреждений.
Соединения меди подавляют вирус свиного гриппа.
Ювелирное дело
Ювелиры используют сплавы на основе меди.
Красное или розовое золото – это конгломерат благородного металла с медью.
Ее количество в составе определяет финальный оттенок:
- 25% – розовый;
- 50% – красный.
Эти виды золота – самые любимые ювелирами. Медь делает изделия прочнее, попутно удешевляя стоимость.
Второй популярный ювелирный сплав – мельхиор (медь + никель).
Другие отрасли
- Оксид меди – основа купрата, используемого в сверхпроводниках.
- Латунь идет на изготовление гильз для винтовок и артиллерии.
- Из мельхиора чеканят монеты, создают интерьерные украшения, столовые приборы.
- Медь задействована при синтезе хлорофилла. Ее всегда добавляют в минеральные удобрения для растений.
Значение для человека
Медь заложена в организм человека изначально:
- Участвует в образовании красных кровяных телец, коллагена, эластина.
- Активирует работу эндокринной системы, замедляет старение организма.
- Ее дефицит чреват замедлением белкового обмена. Это влечет патологии в развитии скелета и составе крови.
Она есть во многих продуктах питания. Медью богаты говяжья печень, устрицы, кунжут, какао-порошок, черный перец, гречневая крупа. А также орехи (лесной, грецкий, кешью, арахис, миндаль).
Предостережение
В составе металла есть изотопы: два стабильных плюс два десятка нестабильных. Хотя период полураспада «долгожителя» – менее 2,5 суток, материал токсичен.
Поэтому применение меди контролируется.
В России на федеральном уровне (национальный стандарт, федеральный Свод Правил) регламентируется:
- Производство и использование медных водо- паро- и газопроводных труб.
- Количество меди в питьевой воде.
В 1 литре питьевой воды не должно быть больше 1 мг меди.
Избыток медных компонентов вызывает отравление организма. Для приготовления пищи медная посуда непригодна.
Карьер, в котором медную руду извлекали открытым способом, становится источником токсичных соединений.
Цены
Мировая цена меди устанавливается на Лондонской бирже металлов. Она зависит от спроса, определяемого состоянием экономики.
И колеблется соответственно:
- К началу 2008 года преодолена психологическая отметка $8000 за тонну.
- Через полгода было уже $+940, что стало рекордом за всю историю биржи.
- На начало 2011 года взята планка $10 000.
Затем произошел спад. На 2021 год тонна меди торгуется по $8057. Сказалось торможение экономики из-за пандемии коронавируса.
Самородная медь размером около 4 см
Медь — минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
- Структура
- Свойства
- Запасы и добыча
- Происхождение
- Применение
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
СТРУКТУРА
Кристаллическая структура меди
Кубическая сингония, гексаоктаэдрический вид симметрии m3m, кристаллическая структура – кубическая гранецентрированная решётка. Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12. Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов. Поверхность часто покрыта плёнками “медной зелени” (малахит), “медной сини” (азурит), фосфатов меди и других продуктов её вторичного изменения.
СВОЙСТВА
Кристаллы самородной меди, Верхнее озеро, округ Кинави, Мичиган, США. Размер 12 х 8,5 см
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
ЗАПАСЫ И ДОБЫЧА
Образец меди, 13,6 см. Полуостров Кинави, Мичиган, США
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10−3% (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе) соответственно. Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
ПРОИСХОЖДЕНИЕ
Небольшой самородок меди
Обычно самородная медь образуется в зоне окисления некоторых медносульфидных месторождений в ассоциации с кальцитом, самородным серебром, купритом, малахитом, азуритом, брошантитом и другими минералами. Массы отдельных скоплений самородной меди достигают 400 тонн. Крупные промышленные месторождения самородной меди вместе с другими медьсодержащими минералами формируются при воздействии на вулканические породы (диабазы, мелафиры) гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение озера Верхнее, США).
Самородная медь встречается также в осадочных породах, преимущественно в медистых песчаниках и сланцах.
Наиболее известные месторождения самородной меди – Туринские рудники (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).
ПРИМЕНЕНИЕ
Браслеты из меди
Из-за низкого удельного сопротивления, медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов.
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы.
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Медь (англ. Copper) – Cu
| Молекулярный вес | 63.55 г/моль |
| Происхождение названия | От греческого “Kyprium”, то есть “кипрский металл”, по названию острова Кипр |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.1
| Strunz (8-ое издание) | 1/A.01-10 |
| Nickel-Strunz (10-ое издание) | 1.AA.05 |
| Dana (7-ое издание) | 1.1.1.3 |
| Dana (8-ое издание) | 1.1.1.3 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | медно-красный, тускнеющий в черный или зеленый на воздухе |
| Цвет черты | медно-красный |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | нет |
| Твердость (шкала Мооса) | 2,5-3 |
| Прочность | ковкий |
| Излом | зазубренный |
| Плотность (измеренная) | 8.94 – 8.95 г/см3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | диамагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Цвет в отраженном свете | розовато-белый |
| Плеохроизм | не плеохроирует |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | m3m (4/m 3 2/m) – гексоктаэдрический |
| Пространственная группа | Fm3m (F4/m 3 2/m) |
| Сингония | кубическая |
| Параметры ячейки | a = 3.615Å |
| Морфология | кубы, додекаэдры и тетрагексаэдры; редко октаэдры и сложные комбинации; нитевидные, древовидные |
| Двойникование | Двойники по {111} по шпинелевому закону |








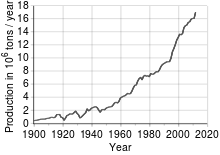





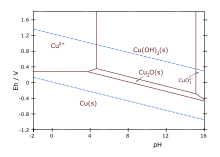

















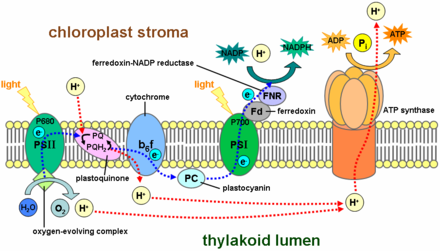































![{displaystyle {mathsf {2Cu+4HCllongrightarrow 2H[CuCl_{2}]+H_{2}uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cc80bfb324a1e02cf0b53b9c94e705f56502ee4d)



![{displaystyle {mathsf {2Cu+4HBrlongrightarrow 2H[CuBr_{2}]+H_{2}uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7373466ccce8c6974185a4abacefcc674e93c182)
![{displaystyle {mathsf {2Cu+4CH_{3}COOH+O_{2}longrightarrow [Cu_{2}(H_{2}O)_{2}(CH_{3}COO)_{4}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/47bacd6a149917fc6fe5885a580c74c071f19740)
![{displaystyle {mathsf {Cu{xrightarrow {NH_{3}cdot H_{2}O,O_{2}}} [Cu(NH_{3})_{2}]OHrightleftarrows [Cu(NH_{3})_{4}](OH)_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6ca473ceb7ed8112750921d3d76541491d1a677f)












![{displaystyle {mathsf {6Cu+12HCl+KClO_{3}longrightarrow 6H[CuCl_{2}]+KCl+3H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0994311aa4eef96edcd63c1259c77c51809bc10f)


![{mathsf {CuCl+Cl^{-}rightarrow [CuCl_{2}]^{-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1ceabd1dd09bb6c906acfc0c1402152bc9397dc5)







![{displaystyle {mathsf {Cu_{2}O+H_{2}O+2OH^{-}rightarrow 2[Cu(OH)_{2}]^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a430cfe578b461e180747ede4c914f33a5cabdd)
![{displaystyle {mathsf {Cu_{2}O+4HClrightarrow 2H[CuCl_{2}]+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/715be4ff1fca9d74ba5e493d98ace7d3f48e29f7)







![{displaystyle {mathsf {Cu_{2}O+4NH_{3}*H_{2}Orightarrow 2[Cu(NH_{3})_{2}]OH+3H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/548b74f8b392e28195be9fc87bfa64841d8cc01f)









![{displaystyle {mathsf {CuOH+2HClrightarrow H[CuCl_{2}]+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/474dc6a48557501f79a4cecaff166f7c974fabd7)

![{displaystyle {mathsf {CuOH+KOHrightarrow K[Cu(OH)_{2}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ed9d4f544a32bcf9e645df7591a57fc73920bf4)

_{2}+3H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/36286b47fa9ba62b37c8364e6023ec740c51bd57)
_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6c1ed7d230399e8c8b8e12ecd9c204088de28256)
![{displaystyle {mathsf {CuO+2OH^{-}+H_{2}Orightarrow [Cu(OH)_{4}]^{2+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5bb22fdc359202f84eba1ebb7b0951d89d62205e)











![{displaystyle {mathsf {Cu(OH)_{2}+OH^{-}rightarrow [Cu(OH)_{4}]^{2+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e7097bc92c2352e72c491f54f9f312aaf39b5aba)




_{2}+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6c30733175565c1ab55b2ef726ab9ec93e307d19)
_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45b3a8d1afd2d4b774591cb499e305f3a0ff7b30)
















